题目内容
8.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.某工程师为了从使用过的腐蚀废液中回收铜,并重新获得氯化铁溶液,准备采用如图步骤:
(1)请写出上述实验中加入或生成的有关物质的化学式:
③Fe和Cu ④HCl⑤HCl和FeCl2 ⑥Cl2
(2)合并溶液通入⑥的离子反应方程式2Fe2++Cl2=2Fe3++2Cl-.
(3)若向②中加入氢氧化钠溶液,其实验现象为先生成白色沉淀,迅速变为灰绿色,最后变为红褐色.
(4)若向废液中加入任意质量的①物质,下面对充分反应后的溶液分析合理的是D
A.若无固体等剩余,则溶液中一定有Fe3+
B.若有固体存在,则溶液中一定没有Cu2+
C.若溶液中有Cu2+,则一定没有固体析出
D.若溶液中有Fe3+,则一定还有Cu2+.
分析 Cu和FeCl3发生反应Cu+2FeCl3=2FeCl2+2CuCl2,所以废液中含有Cu2+、Fe2+,可能含有Fe3+,向废液中加入Fe粉,发生反应Cu2++Fe=Fe2++Cu,然后过滤,滤渣中含有Fe、Cu,滤液中含有FeCl2,向滤渣中加入过量稀盐酸,发生反应Fe+2HCl=FeCl2+H2,然后过滤,得到的滤渣是Cu,滤液中含有HCl、FeCl2,将滤液②⑤混合,然后通入Cl2,发生反应2FeCl2+Cl2=2FeCl3,所以得到氯化铁溶液,
(1)根据推断确定各物质化学式;
(2)合并溶液通入⑥的离子反应为亚铁离子和氯气的氧化还原反应;
(3)若向②中加入氢氧化钠溶液,先生成白色氢氧化亚铁沉淀,氢氧化亚铁不稳定,易被氧化生成氢氧化铁;
(4)若向废液中加入任意质量的①物质,Fe先和Fe3+反应后和Cu2+反应,Cu能和铁离子反应,根据离子反应先后顺序确定溶液中成分.
解答 解:Cu和FeCl3发生反应Cu+2FeCl3=2FeCl2+2CuCl2,所以废液中含有Cu2+、Fe2+,可能含有Fe3+,向废液中加入Fe粉,发生反应Cu2++Fe=Fe2++Cu,然后过滤,滤渣中含有Fe、Cu,滤液中含有FeCl2,向滤渣中加入过量稀盐酸,发生反应Fe+2HCl=FeCl2+H2,然后过滤,得到的滤渣是Cu,滤液中含有HCl、FeCl2,将滤液②⑤混合,然后通入Cl2,发生反应2FeCl2+Cl2=2FeCl3,所以得到氯化铁溶液,
(1)通过以上分析知,③④⑤⑥分别是Fe和Cu、HCl、HCl和FeCl2、Cl2,
故答案为:Fe和Cu;HCl;HCl和FeCl2;Cl2;
(2)合并溶液通入⑥的离子反应为亚铁离子和氯气的氧化还原反应,离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)若向②中加入氢氧化钠溶液,先生成白色氢氧化亚铁沉淀,氢氧化亚铁不稳定,易被氧化生成氢氧化铁,看到的现象是:先生成白色沉淀,迅速变为灰绿色,最后变为红褐色,
故答案为:先生成白色沉淀,迅速变为灰绿色,最后变为红褐色;
(4)若向废液中加入任意质量的①物质,Fe先和Fe3+反应后和Cu2+反应,Cu能和铁离子反应,
A.若无固体等剩余,铁离子还没有完全反应,则溶液中可能有Fe3+,故错误;
B.若有固体存在,如果固体完全是Cu,则溶液中可能有Cu2+,故错误;
C.若溶液中有Cu2+,铁完全反应,则会析出Cu,故错误;
D.若溶液中有Fe3+,则Fe、Cu完全反应,所以一定还有Cu2+,故正确;
故选D.
点评 本题考查物质分离和提纯,为高频考点,明确物质性质、物质反应先后顺序是解本题关键,注意Fe、Cu混合物和含有Fe3+、Cu2+混合溶液反应先后顺序,题目难度不大.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=+725.8kJ/mol | |
| B. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=-1451.6kJ/mol | |
| C. | CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=-725.8kJ/mol | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=+1451.6kJ/mol |
| A. | 已知2C(s)+O2(g)═2CO(g)△H=-221kJ/mol,则C的燃烧热为110.5kJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol | |
| D. | 已知:C(s)+O2(g)=CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,则△H1>△H2 |
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点 c处反应达到平衡 | |
| C. | 点d(t1时刻) 和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,573K下反应至t1时刻,n(H2)比图中d点的值大 |
| A. | CH3COOH | B. | CuSO4 | C. | K2SO4 | D. | NaHCO3 |
 (氧化剂)
(氧化剂)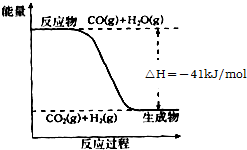 研究化学反应中的能量变化有重要意义.请根据学过知识回答下列问题:
研究化学反应中的能量变化有重要意义.请根据学过知识回答下列问题: