题目内容
20.向盛有KI溶液的试管中加入少许CCl4后滴加氯水(主要成分为Cl2),CCl4层变成紫色.如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色.完成下列填空:(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写)
5(Cl2)+1(I2)+6(H20)═2HIO3+10(HCl)
(2)将氧化剂和还原剂的化学式及其配平后的系数填入下列横线中,并标出电子转移的方向和数目.
(还原剂)
 (氧化剂)
(氧化剂)(3)把KI换成KBr,则CCl4层变为橙红色:继续滴加氯水,CCl4层的颜色没有变化.由此可知,Cl2、HIO3、HBrO3氧化性由强到弱的顺序是HBrO3>Cl2>HIO3.
分析 (1)氯气具有强氧化性,碘能被氯气氧化生成碘酸,同时氯气被还原生成氯化氢;
(2)根据(1)中的反应方程式,利用化合价升降判断氧化剂和还原剂,并标出电子转移的方向和数目;
(3)氯气的氧化性大于溴,所以氯气能氧化溴离子生成溴单质,溴水呈橙色,同一氧化还原反应中氧化剂氧化性大于氧化产物的氧化性,以此分析.
解答 解:(1)氯气具有强氧化性,向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色,说明生成I2,继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色,说明I2被进一步氧化,生成HIO3,同时氯气被还原为HCl,反应物为氯气和碘、水,生成物是碘酸和氯化氢,一个氯气分子参加反应得2个电子,一个碘分子参加反应失去10个电子,该反应中得失电子的最小公倍数是10,所以方程式为I2+5Cl2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H20=2HIO3+10HCl;
(2)根据反应5Cl2+I2+6H20=2HIO3+10HCl可知,氯元素从0价降为-1价,所以氯气是氧化剂,碘元素从0价升为+5价,所以碘是还原剂,每摩尔碘叁加反应过程中共转移10mol电子,所以氧化剂和还原剂的化学式及其配平后的系数并标出电子转移的方向和数目为
(还原剂) (氧化剂),
(氧化剂),
故答案为:(还原剂) (氧化剂);
(氧化剂);
(3)氯气的氧化性大于溴,所以氯气能氧化溴离子生成溴单质,发生的离子反应方程式为Cl2+2Br-=Br2+2Cl-,溴水呈橙红色,继续向溴水中滴加氯水,CCl4层的颜色没有变化,说明氯气的氧化性小于溴酸,氯气能和碘反应生成碘酸,所以氯气的氧化性大于碘酸,所以Cl2、HIO3、HBrO3氧化性由强到弱的顺序是HBrO3>Cl2>HIO3;
故答案为:橙红;HBrO3>Cl2>HIO3.
点评 本题考查了氧化还原反应,明确同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,难度不大.

| A. | 427℃时该反应的平衡常数为9.4,则该反应的△H>0 | |
| B. | 800℃下,该反应的化学平衡常数为0.25 | |
| C. | 同温下,若继续向该平衡体系中通入1.0mol的H2O(g),则平衡时H2O(g)转化率为66.7% | |
| D. | 同温下,若继续向该平衡体系中通入1.0mol的CO(g),则平衡时H2O(g)物质的量分数为11.1% |
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 反应①中的能量变化如图所示: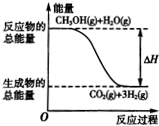 | |
| C. | 根据②推知反应CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ/mol | |
| D. | CH3OH转变成H2的过程一定要吸收能量 |
| A. | 常温下,10mL0.02 mol•L-1 HCl溶液与10mL0.02 mol•L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=11 | |
| B. | 在0.1 mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| C. | 中和物质的量浓度与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 配制三氯化铁溶液时应将三氯化铁溶于浓盐酸,再加水稀释至所需浓度 |
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=9:11.此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-).
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是106:1.
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11.将两种溶液等体积混合,可能发生的现象白色沉淀其主要原因是(用离子方程式表示)AlO2-+HCO3-+H2O=Al(0H)3↓+CO32-.
(4)已知25℃时:
| 难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.0×10-17 |

 以CH4和H2O为原料,通过下列反应来制备甲醇.
以CH4和H2O为原料,通过下列反应来制备甲醇.