题目内容
【题目】机动车尾气和燃煤产生的烟气是目前城市空气污染的重要原因之一。NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) H=-akJ·mol-1
2CO2(g)+N2(g) H=-akJ·mol-1
(1)CO可用于炼铁,已知:
①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H=+489.0kJ/mol
②C(s)+CO2(g)=2CO(g)△H=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为_____________________
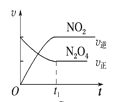
(2)在一定温度下,将1.2 mol NO、1.0 mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示。

0~20 min CO2的平均速率v(CO2)=____________,CO的转化率为____________
(3)下列能够说明该反应已经达到平衡的是__________
a.该容器内压强不再改变
b.上述反应的焓变H不变
c. v(NO)=2v(N2)
d.混合气体的密度不再变化
(4)若保持反应体系的温度不变,20 min时再向容器中充CO、CO2各0.2mol,化学平衡将__________(填“逆向”“正向”或“不”)移动。重新达到平衡后,该反应的化学平衡常数为__________(结果保留两位有效数字)
(5)利用反应2NO2+4CO=N2+4CO2可以处理汽车尾气。若将该反应设计为原电池,用熔融NaCO3作电解质,其正极电极反应式为_____________
(6)工业上用氨水将SO2转化为(NH4)2SO3,再氧化为(NH4)2SO4。已知25℃时,0.05mol/L(NH4)2SO4溶液的pH=a,则c(NH4+):c(NH3·H2O)=__________用含a的代数式表示,已知NH3·H2O的电离常数为Kb=1.7×10-5)。
【答案】Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol 0.01mol/(L·min) 40% a 逆向 0.28 2NO2+8e-+4CO2=N2+4CO32- ![]()
【解析】
(1)根据盖斯定律进行计算;
(2)据图可知0~20min内△c(NO)=0.2mol/L,据v(NO)=![]() 进行计算;CO的转化率=
进行计算;CO的转化率=![]() 进行计算;
进行计算;
(3)反应达到平衡后,正逆反应速率相等,各组分的浓度保持不变及由此衍生的其他物理量进行分析判断;
(4)根据平衡常数的计算公式进行计算;根据浓度商与平衡常数的关系判断反应进行的方向;平衡常数只是温度的函数,据此进行分析;
(5)原电池中正极得电子发生还原反应,该电池放电时NO2被还原成N2作正极,用熔融NaCO3作电解质,根据元素守恒和电荷守恒可得电极方程式;
(6)NH3·H2O的电离常数为Kb=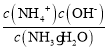 =1.7×10-5,pH=a,则可求出c(OH-),据此可以计算出
=1.7×10-5,pH=a,则可求出c(OH-),据此可以计算出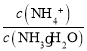 。
。
(1)已知:①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol ①
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ/mol ②
由①-②×3,得到热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol,
(2)据图可知0~20min内△c(NO)=0.2mol/L,所以v(NO)=![]() =0.01mol/(L·min),同一反应同一同时不同物质的反应速率之比等于计量数之比,所以v(CO2)=v(NO)=0.01mol/(L·min);△c(NO)=0.2mol/L,则△c(CO)=0.2mol/L,容器体积为2L,所以CO的转化率为
=0.01mol/(L·min),同一反应同一同时不同物质的反应速率之比等于计量数之比,所以v(CO2)=v(NO)=0.01mol/(L·min);△c(NO)=0.2mol/L,则△c(CO)=0.2mol/L,容器体积为2L,所以CO的转化率为![]() =40%;
=40%;
(3)a.该反应前后气体系数之和不相等,所以未达到平衡时容器内气体总物质的量会变,容器恒容,则压强会变,所以压强不再改变说明反应达到平衡,故a正确;
b.反应是否达到平衡并不影响反应的焓变,故b不能说明;
c.反应达到平衡时正反应速率等于逆反应速率,但选项中没有指明各物质的速率是正反应速率还是逆反应速率,故c不能说明;
d.反应物和生成物均为气体,所以整个过程中气体的总质量不变,容积恒定,则密度一直不变,故d不能说明;
综上所述选a;
(4)初始投料为1.2 mol NO、1.0 mol CO,容器体积为2L,则c(NO)=0.6mol/L,c(CO)=0.5mol/L;据图可知平衡时c(NO)=0.6mol/L,△c(NO)=0.2mol/L,根据方程式可知△c(CO)=0.2mol/L,△c(CO2)=0.2mol/L,△c(N2)=0.1mol/L,所以平衡时各物质的浓度为c(NO)=0.4mol/L,c(CO)=0.3mol/L,c(CO2)=0.2mol/L,c(N2)=0.1mol/L,则该温度下平衡常数为K=![]() ,充CO、CO2各0.2mol后,容器体积为2L,所以c(CO)=0.4mol/L,c(CO2)=0.3mol/L,此时浓度商为
,充CO、CO2各0.2mol后,容器体积为2L,所以c(CO)=0.4mol/L,c(CO2)=0.3mol/L,此时浓度商为![]() ,所以平衡逆向移动;温度不变平衡常数不变,平衡常数为0.28;
,所以平衡逆向移动;温度不变平衡常数不变,平衡常数为0.28;
(5)原电池中正极得电子发生还原反应,根据总反应中各物质的化合价的变化可知,该电池放电时NO2被还原成N2作正极,用熔融NaCO3作电解质,根据元素守恒和电荷守恒可得电极方程式为2NO2+8e-+4CO2=N2+4CO32-;
(6)NH3·H2O的电离常数为Kb=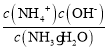 =1.7×10-5,pH=a,则c(OH-)=10a-14mol/L,所以
=1.7×10-5,pH=a,则c(OH-)=10a-14mol/L,所以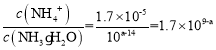 。
。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案