题目内容
【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示:
酸 | 电离平衡常数 |
醋酸 |
|
碳酸 |
|
亚硫酸 |
|
①亚硫酸发生电离的方程式为____________________________________________。
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:_____________________。
③在相同条件下,试比较![]() 、
、![]() 和
和![]() 的酸性强弱:_______> ______>_______。
的酸性强弱:_______> ______>_______。
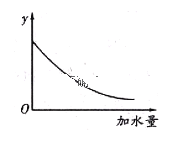
④将pH=4的![]() 溶液稀释100倍后溶液的pH范围是______________________,图中的纵坐标可以是_______________________。
溶液稀释100倍后溶液的pH范围是______________________,图中的纵坐标可以是_______________________。
a.溶液的pH b.醋酸的电离平衡常数 c.溶液的导电能力 d.醋酸的电离程度
⑤若醋酸的初始浓度为0.01 mol/L,平衡时氢离子浓度是________________________(写出详细解题步骤)
⑥写出亚硫酸氢钠与碳酸钠反应的离子方程式_________________________
【答案】![]() 、
、![]() 第一步电离出对第二步电离抑制,需要克服更多作用力
第一步电离出对第二步电离抑制,需要克服更多作用力 ![]()
![]()
![]() 4<pH<6 c
4<pH<6 c ![]() ;
;![]()
![]()
【解析】
多元弱酸应分步电离,第一步电离抑制了第二步电离;比较酸性强弱,可以比较电离平衡常数的大小;弱酸加水稀释,促进了电离,电离程度增大,溶液导电能力减弱,平衡常数不变;根据弱酸的电离平衡常数计算公式进行计算;根据强酸制备弱酸进行方程式的书写。
①根据表中给出的数据,亚硫酸为弱酸,多元弱酸应分步电离,电离方程式为![]() 、
、![]() ;
;
②多元弱酸的第一步电离出对第二步电离抑制,需要克服更多作用力,故碳酸和亚硫酸的第一步电离程度大于第二步电离程度;
③直接由表中的电离平衡常数可知酸性![]() >
>![]() >
>![]() ;
;
④由于醋酸为弱酸,加水稀释促进电离,稀释100倍后其pH在4-6之间;随着溶液的稀释,pH逐渐增大,醋酸的电离平衡常数不发生改变,溶液的导电能力逐渐减弱,醋酸的电离程度逐渐增强,故答案选c;
⑤若醋酸的初始浓度为0.01 mol/L,假设平衡时氢离子浓度为x,![]() ,由于x远小于0.01,可以忽略,可得
,由于x远小于0.01,可以忽略,可得![]() ,解得
,解得![]() ;
;
⑥亚硫酸氢钠与碳酸钠反应的离子方程式为![]() 。
。

【题目】下列操作与现象、结论都正确且有相关性的是
选项 | 操作 | 现象 | 结论 |
A |
|
| 原溶液中仍有 |
B | 向含有ZnS和 | 生成黑色沉淀 |
|
C | 向 | 溶液变浑浊 | 酸性 |
D | 向乙酸乙酯粗产品中加入少量 | 产生大量气泡 | 乙酸乙酯产品中混有乙醇 |
A.AB.BC.CD.D