ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ¥”ΓΑΡœΑΡ“ΜΚ≈Γ±≥Ν¥§÷–ΖΔœ÷ΝΥ¥σΝΩΥΈ¥ζΨΪΟά¥…ΤςΘ§Χεœ÷ΝΥ≤”άΟΒΡ÷–ΜΣΈΡΟςΓΘ«ύΜ®¥…ΧΞΧεΒΡ‘≠Νœ--ΗΏΝκΆΝ![]() Θ§Ω…≤τΫχ¥… ·÷ΤΧΞΘ§«ύΜ®¥…”‘ΝœΒΡ≥…Ζ÷÷ς“Σ «ΦΊ≥Λ ·
Θ§Ω…≤τΫχ¥… ·÷ΤΧΞΘ§«ύΜ®¥…”‘ΝœΒΡ≥…Ζ÷÷ς“Σ «ΦΊ≥Λ ·![]() Θ§‘Ύ
Θ§‘Ύ![]() Ήσ”““Μ¥Έ…’≥…ΒΡ”‘Ω…–Έ≥…ΨΪΟάΒΡ«ύΜ®¥…ΓΘ
Ήσ”““Μ¥Έ…’≥…ΒΡ”‘Ω…–Έ≥…ΨΪΟάΒΡ«ύΜ®¥…ΓΘ
![]() ΗΏΝκΆΝΖ÷Ή”÷–
ΗΏΝκΆΝΖ÷Ή”÷–![]() ______Θ§«ύΜ®¥…______
______Θ§«ύΜ®¥…______![]() ΧνΓΑ τ”ΎΓ±ΜρΓΑ≤Μ τ”ΎΓ±ΙηΥα―Έ≤ζΤΖΓΘ
ΧνΓΑ τ”ΎΓ±ΜρΓΑ≤Μ τ”ΎΓ±ΙηΥα―Έ≤ζΤΖΓΘ
![]() ‘ΎΓΑΡœΑΡ“ΜΚ≈Γ±ΩΦΙ≈÷±≤ΞΙΐ≥Χ÷–Θ§–η”ΟΗΏ¥ΩΕ»
‘ΎΓΑΡœΑΡ“ΜΚ≈Γ±ΩΦΙ≈÷±≤ΞΙΐ≥Χ÷–Θ§–η”ΟΗΏ¥ΩΕ»![]() ÷Τ‘λΒΡΙβœΥΓΘœ¬ΆΦ «”ΟΚΘ±ΏΒΡ ·”Δ…Α
÷Τ‘λΒΡΙβœΥΓΘœ¬ΆΦ «”ΟΚΘ±ΏΒΡ ·”Δ…Α![]() Κ§¬»Μ·ΡΤΓΔ―θΜ·¬ΝΒ»‘”÷
Κ§¬»Μ·ΡΤΓΔ―θΜ·¬ΝΒ»‘”÷ ![]() ÷Τ±ΗΕΰ―θΜ·Ιη¥÷≤ζΤΖΒΡΙΛ“’Νς≥ΧΓΘ
÷Τ±ΗΕΰ―θΜ·Ιη¥÷≤ζΤΖΒΡΙΛ“’Νς≥ΧΓΘ
ΔΌœ¥Β” ·”Δ…ΑΒΡΡΩΒΡ «______ΓΘ
ΔΎ‘Ύ“‘…œΝς≥Χ÷–Θ§“ΣΫΪœ¥ΨΜΒΡ ·”Δ…Α―–ΡΞ≥…ΖέΡ©Θ§ΡΩΒΡ «______ΓΘ
![]() ΙΛ“Β…œ≥Θ”ΟΕΰ―θΜ·Ιη”κΧΦ‘ΎΗΏΈ¬œ¬ΖΔ…ζΖ¥”Π÷Τ‘λ¥÷ΙηΘ§¥÷Ιη÷–Κ§”–SiCΘ§…ζ≥…Έο÷–SiΚΆSiCΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ1ΘΚ
ΙΛ“Β…œ≥Θ”ΟΕΰ―θΜ·Ιη”κΧΦ‘ΎΗΏΈ¬œ¬ΖΔ…ζΖ¥”Π÷Τ‘λ¥÷ΙηΘ§¥÷Ιη÷–Κ§”–SiCΘ§…ζ≥…Έο÷–SiΚΆSiCΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ1ΘΚ![]() –¥≥ωΤδΜ·―ßΖΫ≥Χ Ϋ______ΓΘ
–¥≥ωΤδΜ·―ßΖΫ≥Χ Ϋ______ΓΘ

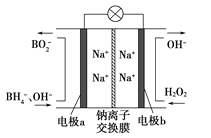
ΓΨ¥πΑΗΓΩ4 τ”Ύ ≥ΐ»ΞΩ…»ή–‘NaCl‘”÷ ‘ω¥σΫ”¥ΞΟφΜΐΘ§Φ”ΩλΖ¥”ΠΥΌ¬ Θ§ΧαΗΏ…ζ≤ζ–߬ 
ΓΨΫβΈωΓΩ
![]() ΗυΨίΜ·ΚœΦέ¥ζ ΐΚΆΈΣΝψΦΤΥψΘΜΙηΥα―Έ≤ζΤΖ «“‘Κ§ΙηΈο÷ ΈΣ‘≠ΝœΨ≠Φ”»»÷Τ≥…ΒΡ÷ς“ΣΑϋά®ΘΚΥ°ΡύΓΔ≤ΘΝßΓΔΧ’¥…ΘΜ
ΗυΨίΜ·ΚœΦέ¥ζ ΐΚΆΈΣΝψΦΤΥψΘΜΙηΥα―Έ≤ζΤΖ «“‘Κ§ΙηΈο÷ ΈΣ‘≠ΝœΨ≠Φ”»»÷Τ≥…ΒΡ÷ς“ΣΑϋά®ΘΚΥ°ΡύΓΔ≤ΘΝßΓΔΧ’¥…ΘΜ
![]() œ¥Β” ·”Δ…ΑΒΡΡΩΒΡ «ΈΣΝΥ≥ΐ»ΞΩ…»ή–‘‘”÷ ΘΜ
œ¥Β” ·”Δ…ΑΒΡΡΩΒΡ «ΈΣΝΥ≥ΐ»ΞΩ…»ή–‘‘”÷ ΘΜ![]() ΫΪœ¥ΨΜΒΡ ·”Δ…Α―–ΡΞ≥…ΖέΡ© «‘ω¥σΫ”¥ΞΟφΜΐΘ§Φ”ΩλΖ¥”ΠΥΌ¬ Θ§ΧαΗΏ…ζ≤ζ–߬ ΘΜ
ΫΪœ¥ΨΜΒΡ ·”Δ…Α―–ΡΞ≥…ΖέΡ© «‘ω¥σΫ”¥ΞΟφΜΐΘ§Φ”ΩλΖ¥”ΠΥΌ¬ Θ§ΧαΗΏ…ζ≤ζ–߬ ΘΜ
![]() ΗυΨίΧβΡΩ–≈œΔΫαΚœ÷ ΝΩ ΊΚψΘ§Ϋχ–– ι–¥Μ·―ßΖ¥”ΠΖΫ≥Χ ΫΓΘ
ΗυΨίΧβΡΩ–≈œΔΫαΚœ÷ ΝΩ ΊΚψΘ§Ϋχ–– ι–¥Μ·―ßΖ¥”ΠΖΫ≥Χ ΫΓΘ
Θ®1Θ©ΗΏΝκΆΝ![]() ÷–Θ§¬ΝΈΣ
÷–Θ§¬ΝΈΣ![]() ΦέΘ§ΙηΈΣ
ΦέΘ§ΙηΈΣ![]() ΦέΘ§―θΈΣ
ΦέΘ§―θΈΣ![]() ΦέΘ§“άΨί¥ζ ΐΚΆΈΣΝψΘ§Ω…÷Σ«β―θΗυάκΉ”Ηω ΐΈΣ4Θ§Φ¥ΗΏΝκΆΝΖ÷Ή”÷–
ΦέΘ§“άΨί¥ζ ΐΚΆΈΣΝψΘ§Ω…÷Σ«β―θΗυάκΉ”Ηω ΐΈΣ4Θ§Φ¥ΗΏΝκΆΝΖ÷Ή”÷–![]() ΘΜΥ°ΡύΓΔ≤ΘΝßΓΔΧ’¥…ΕΦ «¥ΪΆ≥ΈόΜζΖ«Ϋπ τ≤ΡΝœΘ§÷ς“Σ «ΙηΥα―Έ≤ζΤΖΘ§÷Τ±Η‘≠ΝœΕΦ–η“Σ”ΟΒΫΚ§Ιη‘ΣΥΊΒΡΈο÷ Θ§Ι «ύΜ®¥… τ”ΎΙηΥα―Έ≤ζΤΖΘ§
ΘΜΥ°ΡύΓΔ≤ΘΝßΓΔΧ’¥…ΕΦ «¥ΪΆ≥ΈόΜζΖ«Ϋπ τ≤ΡΝœΘ§÷ς“Σ «ΙηΥα―Έ≤ζΤΖΘ§÷Τ±Η‘≠ΝœΕΦ–η“Σ”ΟΒΫΚ§Ιη‘ΣΥΊΒΡΈο÷ Θ§Ι «ύΜ®¥… τ”ΎΙηΥα―Έ≤ζΤΖΘ§
Ι ¥πΑΗΈΣΘΚ4ΘΜ τ”ΎΘΜ
![]() œ¥Β” ·”Δ…ΑΒΡΡΩΒΡ «ΈΣΝΥ≥ΐ»ΞΩ…»ή–‘NaCl‘”÷ Θ§
œ¥Β” ·”Δ…ΑΒΡΡΩΒΡ «ΈΣΝΥ≥ΐ»ΞΩ…»ή–‘NaCl‘”÷ Θ§
Ι ¥πΑΗΈΣΘΚ≥ΐ»ΞΩ…»ή–‘NaCl‘”÷ ΘΜ
![]() ‘Ύ“‘…œΝς≥Χ÷–Θ§“ΣΫΪœ¥ΨΜΒΡ ·”Δ…Α―–ΡΞ≥…ΖέΡ©Θ§ΡΩΒΡ «‘ω¥σΫ”¥ΞΟφΜΐΘ§Φ”ΩλΖ¥”ΠΥΌ¬ Θ§ΧαΗΏ…ζ≤ζ–߬ Θ§
‘Ύ“‘…œΝς≥Χ÷–Θ§“ΣΫΪœ¥ΨΜΒΡ ·”Δ…Α―–ΡΞ≥…ΖέΡ©Θ§ΡΩΒΡ «‘ω¥σΫ”¥ΞΟφΜΐΘ§Φ”ΩλΖ¥”ΠΥΌ¬ Θ§ΧαΗΏ…ζ≤ζ–߬ Θ§
Ι ¥πΑΗΈΣΘΚ‘ω¥σΫ”¥ΞΟφΜΐΘ§Φ”ΩλΖ¥”ΠΥΌ¬ Θ§ΧαΗΏ…ζ≤ζ–߬ ΘΜ
![]() ÷Τ‘λ¥÷Ιη ±ΒΡΖ¥”ΠΈΣ
÷Τ‘λ¥÷Ιη ±ΒΡΖ¥”ΠΈΣ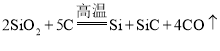 Θ§’ΐΚΟ¬ζΉψ¥÷Ιη÷–Κ§”–SiCΘ§Τδ÷–SiΚΆSiCΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ1ΘΚ1Θ§
Θ§’ΐΚΟ¬ζΉψ¥÷Ιη÷–Κ§”–SiCΘ§Τδ÷–SiΚΆSiCΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ1ΘΚ1Θ§
Ι ¥πΑΗΈΣΘΚ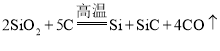 ΓΘ
ΓΘ

 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗΓΨΧβΡΩΓΩ“―÷Σ‘Ύ25Γφ ±,¥ΉΥαΓΔΧΦΥαΚΆ―«ΝρΥαΒΡΒγάκΤΫΚβ≥Θ ΐ»γœ¬±μΥυ Ψ:
Υα | ΒγάκΤΫΚβ≥Θ ΐ |
¥ΉΥα |
|
ΧΦΥα |
|
―«ΝρΥα |
|
ΔΌ―«ΝρΥαΖΔ…ζΒγάκΒΡΖΫ≥Χ ΫΈΣ____________________________________________ΓΘ
ΔΎΧΦΥαΚΆ―«ΝρΥαΒΡΒΎ“Μ≤ΫΒγάκ≥ΧΕ»¥σ”ΎΒΎΕΰ≤ΫΒγάκ≥ΧΕ»ΒΡ‘≠“ρ:_____________________ΓΘ
Δέ‘ΎœύΆ§ΧθΦΰœ¬, ‘±»Ϋœ![]() ΓΔ
ΓΔ![]() ΚΆ
ΚΆ![]() ΒΡΥα–‘«Ω»θ:_______> ______>_______ΓΘ
ΒΡΥα–‘«Ω»θ:_______> ______>_______ΓΘ
ΔήΫΪpH=4ΒΡ![]() »ή“ΚœΓ Ά100±ΕΚσ»ή“ΚΒΡpHΖΕΈß «______________________,ΆΦ÷–ΒΡΉίΉχ±ξΩ…“‘ «_______________________ΓΘ
»ή“ΚœΓ Ά100±ΕΚσ»ή“ΚΒΡpHΖΕΈß «______________________,ΆΦ÷–ΒΡΉίΉχ±ξΩ…“‘ «_______________________ΓΘ
a.»ή“ΚΒΡpH b.¥ΉΥαΒΡΒγάκΤΫΚβ≥Θ ΐ c.»ή“ΚΒΡΒΦΒγΡήΝΠ d.¥ΉΥαΒΡΒγάκ≥ΧΕ»
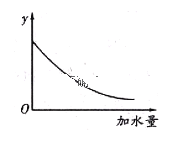
Δί»τ¥ΉΥαΒΡ≥θ Φ≈®Ε»ΈΣ0.01 mol/LΘ§ΤΫΚβ ±«βάκΉ”≈®Ε» «________________________Θ®–¥≥ωœξœΗΫβΧβ≤Ϋ÷ηΘ©
Δό–¥≥ω―«ΝρΥα«βΡΤ”κΧΦΥαΡΤΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ_________________________
ΓΨΧβΡΩΓΩ![]() ÷ς“Σ”ΟΉς―ΓΩσΦΝΓΔΈ±ΉΑΆΩΝœΒΡ―’ΝœΒ»ΓΘ”ΟνήΩσ ·
÷ς“Σ”ΟΉς―ΓΩσΦΝΓΔΈ±ΉΑΆΩΝœΒΡ―’ΝœΒ»ΓΘ”ΟνήΩσ ·![]() Κ§
Κ§![]() ΓΔCoOΦΑ…ΌΝΩ
ΓΔCoOΦΑ…ΌΝΩ![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() Β»
Β»![]() …ζ≤ζ
…ζ≤ζ![]() ΒΡΝς≥Χ»γΆΦ1ΘΚ
ΒΡΝς≥Χ»γΆΦ1ΘΚ
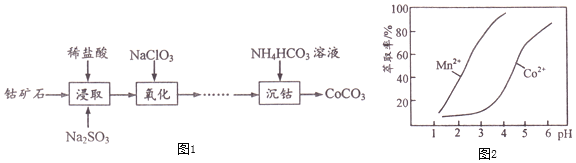
œ¬±μΝ–≥ωΝΥΦΗ÷÷άκΉ”…ζ≥…«β―θΜ·Έο≥ΝΒμΒΡpH![]() ΓΑ≥ΝΒμΆξ»ΪΓ± «÷Η»ή“Κ÷–άκΉ”≈®Ε»ΒΆ”Ύ
ΓΑ≥ΝΒμΆξ»ΪΓ± «÷Η»ή“Κ÷–άκΉ”≈®Ε»ΒΆ”Ύ![]()
|
|
|
|
| |
ΩΣ Φ≥ΝΒμΒΡpH |
|
|
|
|
|
≥ΝΒμΆξ»ΪΒΡpH |
|
|
|
|
|
![]() –¥≥ωΓΑΫΰ»ΓΓ±≤Ϋ÷η
–¥≥ωΓΑΫΰ»ΓΓ±≤Ϋ÷η![]() ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ______ΓΘ
ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ______ΓΘ
![]() ΓΑΫΰ»ΓΓ±≤Ϋ÷η≥ΐ
ΓΑΫΰ»ΓΓ±≤Ϋ÷η≥ΐ![]() ΆβΘ§νήΩσ ·÷–ΜΙΡή±Μ
ΆβΘ§νήΩσ ·÷–ΜΙΡή±Μ![]() ΜΙ‘≠ΒΡΈο÷ ”–______ΓΘ
ΜΙ‘≠ΒΡΈο÷ ”–______ΓΘ
![]() Φ”
Φ”![]() ΒΡΡΩΒΡ «―θΜ·
ΒΡΡΩΒΡ «―θΜ·![]() Θ§
Θ§![]() ΒΡ”ΟΝΩΙΐΕύΜα‘λ≥…ΒΡ≤ΜΝΦΚσΙϊ «______ΓΘ
ΒΡ”ΟΝΩΙΐΕύΜα‘λ≥…ΒΡ≤ΜΝΦΚσΙϊ «______ΓΘ
![]() ΓΑ≥ΝνήΓ±≤Ϋ÷ηœρ
ΓΑ≥ΝνήΓ±≤Ϋ÷ηœρ![]() »ή“ΚΦ”»κ
»ή“ΚΦ”»κ![]() »ή“Κ–η“Σ
»ή“Κ–η“Σ![]() ΧθΦΰœ¬Ϋχ––Θ§ “ΥΒΡΦ”»»ΖΫ ΫΈΣ______ΓΘΈ¬Ε»ΩΊ÷Τ‘Ύ
ΧθΦΰœ¬Ϋχ––Θ§ “ΥΒΡΦ”»»ΖΫ ΫΈΣ______ΓΘΈ¬Ε»ΩΊ÷Τ‘Ύ![]() ΒΡ‘≠“ρΈΣ______ΓΘ
ΒΡ‘≠“ρΈΣ______ΓΘ
![]() “―÷ΣΫπ τίΆ»ΓΦΝΕ‘Ϋπ τάκΉ”ΒΡίΆ»Γ¬ ”κpHΒΡΙΊœΒ»γΆΦ2Υυ ΨΓΘ«κ≤Ι≥δΆξ’ϊ”…ΓΑ―θΜ·Γ±ΚσΒΡ»ή“Κ÷Τ±Η
“―÷ΣΫπ τίΆ»ΓΦΝΕ‘Ϋπ τάκΉ”ΒΡίΆ»Γ¬ ”κpHΒΡΙΊœΒ»γΆΦ2Υυ ΨΓΘ«κ≤Ι≥δΆξ’ϊ”…ΓΑ―θΜ·Γ±ΚσΒΡ»ή“Κ÷Τ±Η![]() ΒΡ Β―ιΖΫΑΗΘΚœρΓΑ―θΜ·Γ±ΚσΒΡ»ή“Κ÷–Φ”»κ______Θ§Φ”»κ
ΒΡ Β―ιΖΫΑΗΘΚœρΓΑ―θΜ·Γ±ΚσΒΡ»ή“Κ÷–Φ”»κ______Θ§Φ”»κ »ή“Κ≥ΝνήΒΟ
»ή“Κ≥ΝνήΒΟ![]() Β―ι÷––κ Ι”Ο ‘ΦΝΘΚ
Β―ι÷––κ Ι”Ο ‘ΦΝΘΚ![]() »ή“ΚΓΔΫπ τίΆ»ΓΦΝΓΔ―ΈΥα
»ή“ΚΓΔΫπ τίΆ»ΓΦΝΓΔ―ΈΥα![]() ΓΘ
ΓΘ
ΓΨΧβΡΩΓΩ“ΜΕ®Έ¬Ε»œ¬Θ§10mL0.40molL-1H2O2»ή“ΚΖΔ…ζ¥ΏΜ·Ζ÷ΫβΓΘ≤ΜΆ§ ±ΩΧ≤βΒΟ…ζ≥…O2ΒΡΧεΜΐ(“―’έΥψΈΣ±ξΉΦΉ¥Ωω)»γœ¬±μΓΘ
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
œ¬Ν––π ω≤Μ’ΐ»ΖΒΡ «(»ή“ΚΧεΜΐ±δΜ·Κω¬‘≤ΜΦΤ)Θ® Θ©
A.0~6minΒΡΤΫΨυΖ¥”ΠΥΌ¬ ΘΚv(H2O2)Γ÷3.3ΓΝ10-2molΓΛL-1ΓΛmin-1
B.6~10minΒΡΤΫΨυΖ¥”ΠΥΌ¬ ΘΚv(H2O2)<3.3ΓΝ10-2molΓΛL-1ΓΛmin-1
C.Ζ¥”Π÷Ν6min ±Θ§c(H2O2)=0.30molΓΛL-1
D.Ζ¥”Π÷Ν6min ±Θ§H2O2Ζ÷ΫβΝΥ50%