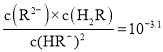��Ŀ����
����Ŀ������������⣺
��1������������:��NaOH��Fe��NaHCO3��CH3COOH��NH4Cl��H2O��ϡ������ NH3��H2O
����ǿ����ʵ���__________;����������ʵ���__________��������ţ�
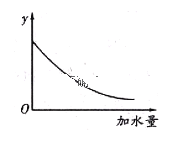
��2�������������ֳƱ����ᡣ��һ���¶���,�������ˮϡ������,��Һ�ĵ�������I�����ˮ�����V�仯��������ͼ��ʾ����ش�:
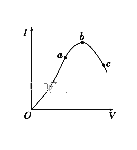
�� ��O���㵼������Ϊ0��������__________��
��a��b��c���㴦,��Һ��c(H+)��С�����˳��Ϊ__________��
��a��b��c���㴦,����̶�������__________��
��ʳ�ð״��У�����Ũ��ԼΪ1mol/L,��֤������Ϊ������ʵ�����_____��
A.�״��е���ʯ����Һ�ʺ�ɫ
B. pH��ֽ��ʾ�����pHΪ2��3
C.���ǽ����ڰ״���������ų�
D. �״��붹�����г�������
E. ȡ��10 mL���ᣬ��pH�Ʋ����pHΪa��Ȼ��������ˮϡ����100 mL������pH�Ʋ����pHΪb ��b��a+1
���𰸡��٢ۢ� �ܢޢ� ������δ���� c��a��b c BF
��������
��1����ȫ����ĵ����Ϊǿ����ʣ�ǿ�ᡢǿ��ʹ��������ǿ����ʣ����ֵ���ĵ������������ʣ��������������������ʣ�
��2����-����Һ�ĵ�����������Ũ���йأ�����Ũ��Խ������Խǿ����������Խǿ������Ũ��Խ��������Ũ��Խ��������ʡ���ˮϡ�ͣ��ٽ����룻
��ǿ������ʵĸ��������������̶ȣ�ֻҪ��֤�����Ჿ�ֵ������֤��������������ʣ����Ը���һ��Ũ�ȴ���pH����������Һ����Եȷ����жϡ�
��1������ǿ����ʵ�Ϊ�٢ۢݣ�����������ʵ�Ϊ�ܢޢࣻ
��2���� ��O���㵼������Ϊ0˵����Һ��û�������ƶ����������ӣ���������δ���룻
����Һ������Ũ��Խ���䵼����Խǿ���������������Ũ�ȴ�С��ϵΪc��a��b��
�۶���������ʣ���ҺԽϡ�������̶�Խ����̶�����Ϊc�㣻
��A. ����ʯ��ʺ�ɫ��˵����Һ���������ӣ���֤����Ϊ������ʣ�
B. 1mol/L�Ĵ�����Һ��pHΪ2-3��˵���䲻��ȫ���룬����֤����Ϊ������ʣ�
C. ���ǿ���״�Ӧ��������˵�����к��������ӣ���֤����Ϊ������ʣ�
D. �״��붹�����г���������˵���״�Ϊ����ʣ���֤����ǿ����
E. ȡ��10 mL���ᣬ��pH�Ʋ����pHΪa��Ȼ��������ˮϡ����100 mL������pH�Ʋ����pHΪb ��b��a+1��˵���䲻��ȫ���룬����֤����Ϊ������ʣ�
��ѡBF��

 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�����Ŀ����֪��25��ʱ,���ᡢ̼���������ĵ���ƽ�ⳣ�����±���ʾ:
�� | ����ƽ�ⳣ�� |
���� |
|
̼�� |
|
������ |
|
�������ᷢ������ķ���ʽΪ____________________________________________��
��̼���������ĵ�һ������̶ȴ��ڵڶ�������̶ȵ�ԭ��:_____________________��
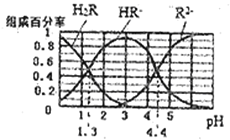
������ͬ������,�ԱȽ�![]() ��
��![]() ��
��![]() ������ǿ��:_______> ______>_______��
������ǿ��:_______> ______>_______��
�ܽ�pH=4��![]() ��Һϡ��100������Һ��pH��Χ��______________________,ͼ�е������������_______________________��
��Һϡ��100������Һ��pH��Χ��______________________,ͼ�е������������_______________________��
a.��Һ��pH b.����ĵ���ƽ�ⳣ�� c.��Һ�ĵ������� d.����ĵ���̶�
��������ij�ʼŨ��Ϊ0.01 mol/L��ƽ��ʱ������Ũ����________________________��д����ϸ���ⲽ�裩
��д��������������̼���Ʒ�Ӧ�����ӷ���ʽ_________________________