题目内容
【题目】室温下,用相同浓度的NaOH 溶液,分别滴定等体积且浓度均为0.1mol/L的三种酸(HA、HB 和HD)溶液,滴定的曲线如图所示,下列判断正确的是
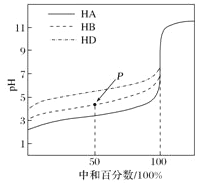
A. 三种酸的电离常数关系:K(HD)>K(HB)>K(HA)
B. pH=7 时,三种溶液中:c(A-)=c(B-)=c(D-)
C. 当三种酸中和百分数达100%时,离子总浓度最大的是NaD 溶液
D. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
【答案】D
【解析】A. 相同物质的量浓度的一元酸,酸的pH越小,氢离子浓度越大,说明酸的电离程度越大,该酸的酸性越强,其电离平衡常数也越大,据图可知,未加NaOH溶液时,pH:HA<HB<HD,说明酸的电离程度HA>HB>HD,则K(HA)>K(HB)>K(HD),故A错误;B. 室温下,溶液的pH=7时,溶液中c(H+)=c(OH),根据电荷守恒,三种溶液中离子浓度关系为:c(Na+)+c(H+)=c(A)+c(OH),由c(H+)=c(OH)可知,c(Na+)=c(A),同理,c(Na+)=c(B)、c(Na+)=c(D),因A、B、D的水解程度不同,则溶液呈中性时消耗氢氧化钠溶液的体积不同,所得的三种溶液中钠离子浓度不同,所以c(A)、c(B)、c(D)也不同,故B错误;C. 当三种酸中和百分数达100%时,三种酸所消耗的氢氧化钠溶液体积相同,生成的钠盐浓度也相同,则三种溶液中c(Na+)相等,根据水解离子方程式可知,c(X)+c(OH)也相等(X代表A、B、D),因HD酸性最弱,D水解程度最大,则NaD溶液中c(OH)最大,c(H+)最小,所以c(Na+)+c(H+)+c(D)+c(OH)最小,故C错误 ;D. 滴定至P点时,HB溶液的中和百分数为50%,所得溶液中c(HB):c(NaB)=1:1,P点时溶液显酸性,说明HB的电离程度大于B的水解程度,c(H+)>c(OH),根据电荷守恒c(Na+)+c(H+)=c(OH)+c(B)可知,c(B)>c(Na+),因HB发生电离:HB![]() H++B,所以c(Na+)>c(HB)>c(H+),则c(B)>c(Na+)>c(HB)>c(H+)>c(OH),故D正确;答案选D。
H++B,所以c(Na+)>c(HB)>c(H+),则c(B)>c(Na+)>c(HB)>c(H+)>c(OH),故D正确;答案选D。