题目内容
【题目】氯化钴渗入水泥中可以制备彩色水泥(变色水泥)。以某废钴渣(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO和SiO2)制备氯化钴晶体的一种流程如下:

已知:①在酸性条件下,氧化性:Co3+>Cl2>H2O2>Fe3+。
②当pH=5时,Fe3+、Al3+全部转化为氢氧化物沉淀。请回答下列问题:
(1)滤渣A的主要成分是_______________、_______________(填化学式)。
(2)在滤液A中加入H2O2,H2O2作还原剂的离子方程式为_______________
(3)从滤渣B中提取铁红的操作是将滤渣B溶于过量的_______________溶液(填化学式),_______________、洗涤、灼烧得到铁红。
(4)从环境保护角度分析,溶解废钴渣时不用浓盐酸替代硫酸的原因是:_______________
(5)为了测定CoCl2nH2O中结晶水数目进行如下实验:取16.6g样品在一定条件下脱水得13.0gCoCl2,则n=_______________
【答案】SiO2 CaSO4 2Co3++H2O2=2Co2++O2↑+2H+ NaOH 过滤 可能会产生Cl2污染环境 2
【解析】
根据流程图分析可知,废钴渣加入过量的稀硫酸,除了SiO2外,均可以与硫酸反应,此外硫酸钙是微溶物。加入双氧水可以将Fe2+氧化成Fe3+,但是从后面的产物来推断,Co3+将被还原成Co2+,加入Na2CO3沉淀Al3+、Fe3+,与Co2+分离,最后得到CoCl2,据此分析解答问题。
(1)分析原料成分知,二氧化硅不溶于硫酸,氧化钙与硫酸生成硫酸钙,硫酸钙微溶于水,滤渣A主要成分是SiO2和CaSO4;
(2)根据后面的产物可知Co为+2价,加入双氧水将+3价钴离子还原成+2价钴离子,双氧水被氧化生成O2,离子方程式为2Co3++H2O2=2Co2++O2↑+2H+;
(3)滤渣B中主要含有氢氧化铁和氢氧化铝,氢氧化铝溶于强碱而氢氧化铁不会,所以是将滤渣B溶于过量的NaOH溶液,过滤得氢氧化铁,洗涤、灼烧氢氧化铁得氧化铁;
(4)用浓盐酸替代硫酸,根据已知氧化性排序Co3>Cl2,三氧化二钴氧化盐酸生成氯气,氯气污染环境;
(5)16.6 g样品在一定条件下脱水得13.0 g CoCl2,
![]() ,
,
![]() ,所以物质的量之比为1:2,故n=2。
,所以物质的量之比为1:2,故n=2。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(1)ClO2的制备(已知:SO2+2NaClO3+H2SO4═2ClO2+2NaHSO4。)

①整套装置正确的链接顺序为(填A~E)A→_______________。
②装置D的作用是_______________。
(2)ClO2与Na2S的反应
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入如图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究Ⅰ中反应的产物。

操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液于试管甲中,滴加品红溶液和盐酸 | 品红溶液始终不褪色 | ①无生成 |
另取少量Ⅰ中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ② | 有 |
③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙中,_______________ | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为_______________,用于处理含硫废水时,ClO2相对于Cl2的优点是_______________(任写一条)。
【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示:
酸 | 电离平衡常数 |
醋酸 |
|
碳酸 |
|
亚硫酸 |
|
①亚硫酸发生电离的方程式为____________________________________________。
②碳酸和亚硫酸的第一步电离程度大于第二步电离程度的原因:_____________________。
③在相同条件下,试比较![]() 、
、![]() 和
和![]() 的酸性强弱:_______> ______>_______。
的酸性强弱:_______> ______>_______。
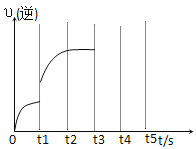
④将pH=4的![]() 溶液稀释100倍后溶液的pH范围是______________________,图中的纵坐标可以是_______________________。
溶液稀释100倍后溶液的pH范围是______________________,图中的纵坐标可以是_______________________。
a.溶液的pH b.醋酸的电离平衡常数 c.溶液的导电能力 d.醋酸的电离程度

⑤若醋酸的初始浓度为0.01 mol/L,平衡时氢离子浓度是________________________(写出详细解题步骤)
⑥写出亚硫酸氢钠与碳酸钠反应的离子方程式_________________________