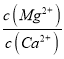题目内容
【题目】X、Y、Z 是短周期元素,在周期表中的位置关系如图所示,下列说法不正确的是
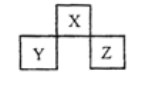
A.X、Z的原子序数之和与Y 的原子序数之比可能为5:3
B.X最简单的气态氢化物的稳定性一定高于Y的气态氢化物
C.Z单质的熔点一定高于Y单质
D.若Z的最高价氧化物为Z2O7,则Y的气态氢化物为YH3
【答案】C
【解析】
根据这三种元素在周期表中的位置结合X、Y、Z是短周期元素判断,X属于第二周期元素,Y和Z是第三周期元素;
A.根据XYZ始终元素的位置关系计算X的原子序数,注意X的原子序数不大于10,且是整数;
B.同一周期元素,非金属元素氢化物的稳定性随着原子序数的增大而增大;同一主族元素,非金属元素氢化物的稳定性随着原子序数的增大而减小;
C.根据元素可能为金属或非金属判断,若是金属,金属单质的熔点增大;若是非金属,非金属单质的熔点减小;
D.根据Z的最高价氧化物判断Z的族序数,从而确定Y的族序数,根据Y的族序数确定其氢化物的化学式;
A.设X的原子序数为a,a必须是正整数且不小于10.则Y的原子序数是a+7,Z的原子序数是a+8
(a+a+9): (a+7)=5:3,a=8,是氧元素,A项正确;
B.由图知,X的非金属性大于其同主族的第三周期元素的非金属性,Y的非金属性小于同一周期的其右边紧相邻主族元素的非金属性,所以X的非金属性大于Y的非金属性,导致X的气态氢化物的稳定性一定高于Y的气态氢化物,B项正确;
C.根据这三种元素在周期表中的位置知,Z和Y可能是金属单质,也可能是非金属单质,如果是金属单质,Z的熔点大于Y,如果是非金属单质,则Y的熔点大于Z,C项错误.
D.若Z的最高价氧化物为Z2O7,Z的化合价是+7价,所以Z是第ⅤⅡA族元素,则Y是第ⅤA族元素,Y的最高化合价是+5价,最低化合价是-3价,所以其气态氢化物的化学式为YH3,D项正确;
答案选C。

【题目】T℃时,体积均为0.5L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g) ![]() 2C(g)△H=-QkJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
2C(g)△H=-QkJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 放热 0.75QkJ |
② | 0.4 | 0.2 | 1.6 | |
下列叙述中正确的是( )
A. 容器①、②中反应的平衡常数均为4
B. 容器②中达到平衡时放出的热量为0.05QkJ
C. 向容器①中通入氦气,平衡时A的转化率不变
D. 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3
【题目】下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 在密闭容器中有反应:A+xB(g) | A非气体、x=1 |
C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
D | 向5mL 0.005mol·L-1 FeCl3溶液中加入5mL 0.015mol·L-1 KSCN溶液,溶液呈红色,再滴加几滴1 mol·L-1 KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
A. A B. B C. C D. D