题目内容
【题目】在常温下,有下列五种溶液:A.0.1mol/LNH4Cl B.0.1mol/L CH3COONH4 C.0.1mol/LNH4HSO4 D.0.1mol/LNH4HCO3 E.0.1mol/LNaHCO3
请根据要求填写下列空白:
(1)溶液A呈___性(填“酸”、“碱”或“中”),其原因是:___(用离子方程式表示)。
(2)溶液E呈___性(填“酸”、“碱”或“中”),其原因是:___(用离子方程式表示)。
(3)比较溶液A、C中c(NH4+)的大小关系是A___C(填“>”、“<”或“=”)。
(4)常温下,测得溶液B的pH=![]() ,则CH3COO-的水解程度___NH4+的水解程度(填“>”、“<”或“=”),CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)___c(NH4+)(填“>”、“<”或“=”)。
,则CH3COO-的水解程度___NH4+的水解程度(填“>”、“<”或“=”),CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)___c(NH4+)(填“>”、“<”或“=”)。
【答案】酸 NH4++H2O![]() NH3·H2O+H+ 碱 HCO3-+H2O
NH3·H2O+H+ 碱 HCO3-+H2O![]() H2CO3+OH- < = =
H2CO3+OH- < = =
【解析】
NH4Cl是强酸弱碱盐,NaHCO3是强碱弱酸盐,结合盐类水解的规律分析解答(1)和(2);
(3)氢离子抑制铵根离子水解,据此分析判断;
(4)室温下,pH=7,说明溶液中氢离子浓度等于氢氧根离子浓度,结合盐类水解的规律和电荷守恒分析判断。
(1)0.1mol/L NH4Cl是强酸弱碱盐,水解呈酸性,其原因是 NH4++H2ONH3H2O+H+,故答案为:酸;NH4++H2ONH3H2O+H+;
(2)0.1mol/LNaHCO3是强碱弱酸盐,水解呈碱性,其原因是 HCO3-+H2O![]() H2CO3+OH-,故答案为:碱;HCO3-+H2O
H2CO3+OH-,故答案为:碱;HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
(3)氢离子抑制铵根离子水解,所以相同浓度的NH4Cl和NH4HSO4溶液中铵根离子浓度A<C,故答案为:<;
(4)室温下,pH=7,说明溶液中氢离子浓度等于氢氧根离子浓度,根据电荷守恒得c(CH3COO-)=c(NH4+),说明CH3COO-的水解程度与NH4+的水解程度相同,故答案为:=;=。

【题目】已知NO2和N2O4可以相互转化:反应2NO2(g)![]() N2O4(g)△H=﹣57.2kJ/mol。
N2O4(g)△H=﹣57.2kJ/mol。
(1)一定温度下,现将1molN2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是___(填序号,下同)。
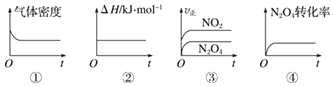
(2)若反应2NO2(g)N2O4(g)在体积为1L的恒容密闭容器中进行,保持温度不变,达到平衡后,向反应容器中再充入少量N2O4,平衡向___移动(填“左”、“右”或“不”),重新平衡后和原平衡相比,混合气体颜色___(填“变深”“变浅”或“不变”),N2O4 的体积分数___(填“增大”、“减小”或“不变”)。
(3)一定温度下,向容积为20L的密闭容器中充入1molNO2气体,发生反应2NO2(g)N2O4(g),反应中测得相关数据如表所示:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
气体相对分子质量 | 46 | 57 | 64 | 69 | 69 | 69 |
①此条件下该反应的化学平衡常数K=___。
②在50min末,向容器中加入![]() molNO2,若要保持平衡不发生移动,应加入N2O4为___mol。
molNO2,若要保持平衡不发生移动,应加入N2O4为___mol。
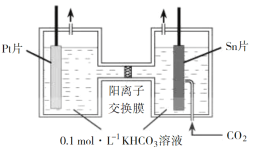
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
【题目】用零价铁![]() 去除水体中的硝酸盐
去除水体中的硝酸盐![]() 已成为环境修复研究的热点之一.
已成为环境修复研究的热点之一.

![]() 还原水体中
还原水体中![]() 的反应原理如图1所示.
的反应原理如图1所示.
①作负极的物质是______.
②正极的电极反应式是______.
![]() 将足量铁粉投入水体中,经24小时测定
将足量铁粉投入水体中,经24小时测定![]() 的去除率和pH,结果如下:
的去除率和pH,结果如下:
初始pH |
|
|
| 接近 |
|
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
![]() 时,
时,![]() 的去除率低.其原因是______.
的去除率低.其原因是______.
![]() 实验发现:在初始
实验发现:在初始![]() 的水体中投入足量铁粉的同时,补充一定量的
的水体中投入足量铁粉的同时,补充一定量的![]() 可以明显提高
可以明显提高![]() 的去除率.对
的去除率.对![]() 的作用提出两种假设:
的作用提出两种假设:
Ⅰ![]() 直接还原
直接还原![]() ;
;
Ⅱ![]() 破坏
破坏![]() 氧化层.
氧化层.
①做对比实验,结果如图2所示,可得到的结论是______.
②同位素示踪法证实![]() 能与
能与![]() 反应生成
反应生成![]() 结合该反应的离子方程式,解释加入
结合该反应的离子方程式,解释加入![]() 提高
提高![]() 去除率的原因:______.
去除率的原因:______.
![]() 其他条件与
其他条件与![]() 相同,经1小时测定
相同,经1小时测定![]() 的去除率和pH,结果如表:
的去除率和pH,结果如表:
初始pH |
|
|
| 约 | 约 |
1小时pH | 接近中性 | 接近中性 |
与![]() 中数据对比,解释
中数据对比,解释![]() 中初始pH不同时,
中初始pH不同时,![]() 去除率和铁的最终物质形态不同的原因:______.
去除率和铁的最终物质形态不同的原因:______.