题目内容
【题目】下列说法或表示正确的是
A.氯化钠晶体中,每个Na+周围距离相等且紧邻的Na+共有12个
B.酒石酸(HOOC-CHOH-CHOH-COOH)不存在手性碳原子
C.熔点:MgBr2<SiCl4<SiC
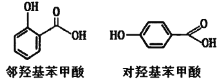
D.邻羟基苯甲酸分子内形成了氢键,所以沸点高于对羟基苯甲酸
【答案】A
【解析】
氯化钠晶体中,Na+位于顶点和面心;手性碳原子指与碳相连的4个基团均不一样;晶体的熔沸点通常规律:原子晶体>离子晶体>分子晶体;分子间氢键,物质的熔沸点反常的高,分子内氢键,物质的熔沸点更低。
A.氯化钠晶体中,Na+位于顶点和面心,每个Na+周围距离相等且紧邻的Na+共有12个,故A正确;
B.手性碳原子指与碳相连的个基团均不一样,由酒石酸的结构式可知,中间2个碳原子均是手性碳原子,2号碳上连接的是氢、羟基、羧基、-CHOH-COOH,故B错误;
C.晶体的熔沸点通常规律:原子晶体>离子晶体>分子晶体,MgBr2是离子晶体,SiCl4是分子晶体,SiC是原子晶体,故熔点:SiCl4<MgBr2< SiC,故C错误;
D.邻羟基苯甲酸与对羟基苯甲酸同为分子晶体,相对分子质量一样,互为同分异构体,分子间氢键,物质的熔沸点反常的高,分子内氢键,物质的熔沸点更低,所以沸点:邻羟基苯甲酸<对羟基苯甲酸;
答案选A。

练习册系列答案
相关题目