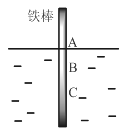
题目内容
【题目】氮、磷、砷是同族元素,请回答下列问题。
(1)氮与元素周期表同周期的相邻元素的第一电离能由小到大的顺序为:_____________(用元素符号表示)。
(2)氨水溶液中存在多种氢键,任意表示出其中一种:____________________。
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是___________(填序号)。
a.不能与NaOH反应 b.含离子键、共价键 c.能与水反应
(4)氮原子间能形成氮氮三键,而砷原子间不易形成三键的原因:_____________________。
(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。
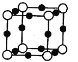
①X的核外电子排布式为________________________。与同一个N3-相连的X+有______个。
②X的高价阳离子(X2+)在水溶液中存在离子[X(H2O)4]2+,则X2+与H2O之间的键型为_____。
③请画出[X(H2O)4]2+离子的结构式_________________(用元素符号写结构式)。
【答案】C<O<N O-H┄N(或O-H┄O、N-H┄O、N-H┄N) bc 砷原子半径较大,原子间形成的δ键较长,p-p轨道肩并肩重叠程度较小或难以重叠,难以形成π键 ls22s22p63s23p63d104s1 6 配位键 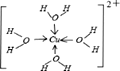
【解析】
第一电离能是指基态气态原子失去最外层一个电子所需能量,同一周期,大体呈从左往右增大的规律,氮的2p能级半满,更稳定;氢键是H与N、O、F原子之间形成的一种特殊键,物质中有O-H、N-H、F-H键均可形成氢键;PH3与HI反应可以通过NH3与HCl过分析,产物是NH4Cl,分析NH4Cl具有的性质;在元素周期表中,同一主族从上到下,原子半径增大,π键是p-p轨道肩并肩重叠形成的; X+中所有电子正好充满K、L、M三个电子层,则有2+8+18=28个电子,则X为29号元素铜,根据晶体结构图可以推断出黑色小球代表X+,白色小球代表N3-,X2+有空轨道,H2O中氧原子有孤电子对,X2+与H2O之间形成配位键,氧原子有孤电子对,所以配位键由氧指向X,配位数为4。
(1)第一电离能是指基态气态原子失去最外层一个电子所需能量,同一周期,大体呈从左往右增大的规律,氮的2p能级半满,更稳定,所以氮与元素周期表同周期的相邻元素的第一电离能由小到大的顺序为:C<O<N;
故答案为:C<O<N;
(2) 氢键是N、O、F原子之间形成的一种特殊键,氨水溶液中与均可以形成氢键,所以有以下四种:水与水:O-H┄O,水与氨:O-H┄N,氨与氨:N-H┄N,氨与水:N-H┄O,以上任一种均可;
故答案为:O-H┄N(或O-H┄O、N-H┄O、N-H┄N);
(3) PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似,PH3与HI反应的产物性质推断,可以用NH3与HCl的反应产物NH4Cl来分析,NH4Cl可以与NaOH反应,且NH4Cl含离子键、共价键,铵根会发生水解反应,所以选bc;
故答案为:bc;
(4) 在元素周期表中,同一主族从上到下,原子半径增大,砷原子的半径更大,若形成三键,则含δ键和π键,半径越长,p-p轨道肩并肩重叠越难,所以砷原子不易形成三键;
故答案为:砷原子半径较大,原子间形成的δ键较长,p-p轨道肩并肩重叠程度较小或难以重叠,难以形成π键;
(5) ①X+中所有电子正好充满K、L、M三个电子层,则有2+8+18=28个电子,则X为29号元素铜,铜的核外电子排布式为:ls22s22p63s23p63d104s1,根据晶体结构图可以推断出黑色小球代表X+,白色小球代表N3-,故同一个N3-相连的X+有6个(上下左右前后);②X2+有空轨道,H2O中氧原子有孤电子对,故二者之间形成配位键;③X2+与H2O之间形成配位键,氧原子有孤电子对,所以配位键由氧指向X,配位数为4,故结构简式为: ;
;
故答案为:ls22s22p63s23p63d104s1 ; 6 ;配位键;  。
。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案