��Ŀ����
����Ŀ����֪NO2��N2O4�����ת������Ӧ2NO2��g��![]() N2O4��g����H����57.2kJ/mol��
N2O4��g����H����57.2kJ/mol��
��1��һ���¶��£��ֽ�1molN2O4����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����___������ţ���ͬ����
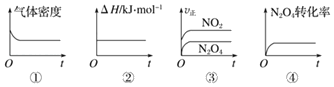
��2������Ӧ2NO2��g��N2O4��g�������Ϊ1L�ĺ����ܱ������н��У������¶Ȳ��䣬�ﵽƽ�����Ӧ�������ٳ�������N2O4��ƽ����___�ƶ���������ҡ�������������ƽ����ԭƽ����ȣ����������ɫ___����������dz�����䡱����N2O4 ���������___�����������С�����䡱����
��3��һ���¶��£����ݻ�Ϊ20L���ܱ������г���1molNO2���壬������Ӧ2NO2��g��N2O4��g������Ӧ�в��������������ʾ��
��Ӧʱ��/min | 0 | 10 | 20 | 30 | 40 | 50 |
������Է������� | 46 | 57 | 64 | 69 | 69 | 69 |
�ٴ������¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K��___��
����50minĩ���������м���![]() molNO2����Ҫ����ƽ�ⲻ�����ƶ���Ӧ����N2O4Ϊ___mol��
molNO2����Ҫ����ƽ�ⲻ�����ƶ���Ӧ����N2O4Ϊ___mol��
���𰸡��٢� �� ���� ���� 60 ![]()
��������
��1��δ�ﵽƽ��״̬ʱ��ϵ��ijЩֵ�Dz��ϱ仯�ģ�����Щֵ����ʱ��˵����Ӧ�ﵽƽ��״̬��
��2��������������Ϊ����ɫ������������Ũ����������ɫ���
��3����ƽ�ⳣ��K=![]() ��
��
��Ũ���̵���ƽ�ⳣ��ʱƽ�ⲻ�����ƶ���
��1��a.�÷�Ӧ������仯�ķ�Ӧ���ܱ������������������䣬�����ܶȲ��䣬˵���ﵽ��ƽ��״̬���ʢ���ȷ��
b.��Ӧ�ȡ�H�뻯ѧ��Ӧ����ʽ�йأ��Dz��仯�ģ����ԡ�Hʼ�ղ��䣬�����ж��Ƿ�ﵽƽ��״̬���ʢڴ���
c.��������Ӧ���ʴ�С��ϵ�����ж�ͬһ���ʵ����淴Ӧ�����Ƿ���ȣ��ʢ۴���
d.������������ת���ʲ��䣬˵��������������Ũ�Ȳ��䣬˵����Ӧ�ﵽ��ƽ��״̬���ʢ���ȷ��
�ʴ�Ϊ���٢ܣ�
��2�����淴ӦΪ2NO2��g��N2O4��g�����ﵽƽ�����Ӧ�������ٳ�������N2O4��������Ũ������ƽ�������ƶ���c��NO2�������������ɫ��������ܱ��������������ʱ�ɿ�������ѹǿ��ѹǿ����ʱƽ�������ƶ�������N2O4������������ʴ�Ϊ���������
��3���ٷ�Ӧ2NO2��g��N2O4��g��������ʽΪ��
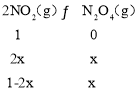
������������Ϊ46g��ƽ��ʱ������������Է�������Ϊ69����69��1��2x+x����46��x��![]() mol��c��NO2����c��N2O4����
mol��c��NO2����c��N2O4����![]() ��
��![]() mol/L��
mol/L��
�� �÷�Ӧ�Ļ�ѧƽ�ⳣ��K��![]() ��
��![]() ��60���ʴ�Ϊ��60��
��60���ʴ�Ϊ��60��
����ƽ��ʱN2O4��Ũ��Ϊc��N2O4�����������м���![]() molNO2����ʱc��NO2����
molNO2����ʱc��NO2����![]() ��0.05mol/L����ѧƽ�ⳣ��K��
��0.05mol/L����ѧƽ�ⳣ��K��![]() ��
��![]() ��60����c��N2O4����0.15mol/L��n��N2O4����cV��20L��0.15mol/L��3mol������Ӧ����N2O4�����ʵ���Ϊ3mol��
��60����c��N2O4����0.15mol/L��n��N2O4����cV��20L��0.15mol/L��3mol������Ӧ����N2O4�����ʵ���Ϊ3mol��![]() mol��
mol��![]() mol���ʴ�Ϊ��
mol���ʴ�Ϊ��![]() ��
��

 ����������ϵ�д�
����������ϵ�д�