��Ŀ����
��֪25 �桢101 kPa�£���1 mol̼ԭ�ӵ�ʯī��ȫȼ������CO2�ų�����393.51 kJ����1 mol̼ԭ�ӵĽ��ʯ��ȫȼ������CO2�ų�395.41 kJ���������ݴ��жϣ�����˵����ȷ���ǣ� ��
| A����ʯī�Ʊ����ʯ�����ȷ�Ӧ��������ʱ��ʯī�������Ƚ��ʯ�ĵ� |
| B����ʯī�Ʊ����ʯ�����ȷ�Ӧ��������ʱ��ʯī�������Ƚ��ʯ�ĸ� |
| C����ʯī�Ʊ����ʯ�Ƿ��ȷ�Ӧ��������ʱ��ʯī�������Ƚ��ʯ�ĵ� |
| D����ʯī�Ʊ����ʯ�Ƿ��ȷ�Ӧ��������ʱ��ʯī�������Ƚ��ʯ�ĸ� |
A
���������������������ͬ�����������1 mol̼ԭ�ӵ�ʯī����ʯ��Ӧ����CO2�ų��������ʯ��ʯī�࣬˵��������ʱ��ʯī�������Ƚ��ʯ�ĵ͡����������е�����Խ�ͣ����ʵ��ȶ��Ծ�Խǿ����ʯī�Ʊ����ʯ�����ȷ�Ӧ�����ѡ����A��
���㣺������ʯ��ʯī�������Ƚϼ��ת��ʱ�������Ĺ�ϵ��֪ʶ��

��8�֣�ѡ������������д���пհף�
| A���������� | B������þ | C��He | D���������� |
��1�������д��ڷ��ӵ��� ����2�������м������Ӽ����й��ۼ����� ��
��3���ڻ�ʱ��Ҫ�ƻ����ۼ����� ����4����������ˮ�ķ��Ӿ����� ��
�״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����
��CH3OH(g)��H2O(g)��CO2(g)��3H2(g) ?��H ����49.0 kJ/mol
��CH3OH(g)��1/2O2(g)��CO2(g)��2H2(g) ?��H����192.9 kJ/mol
����������Ӧ������˵����ȷ����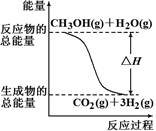
| A����Ӧ���е������仯����ͼ��ʾ |
| B������֪2H2(g)��O2(g)��2H2O(g)?��H����483.8 kJ/mol |
| C��1 mol CH3OH���ȼ�շų�������Ϊ192.9 kJ |
| D��CH3OHת���H2�Ĺ���һ��Ҫ�������� |
̽��NaHCO3��Na2CO3������(��������Ũ�Ⱦ�Ϊ1 mol��L��1)��Ӧ�����е���ЧӦ��ʵ�����������ݣ�
| ��� | 35 mL�Լ� | ���� | ���ǰ �¶�/�� | ��Ϻ� �¶�/�� |
| �� | ˮ | 2.5 g NaHCO3 | 20.0 | 18.5 |
| �� | ˮ | 3.2 g Na2CO3 | 20.0 | 24.3 |
| �� | ���� | 2.5 g NaHCO3 | 20.0 | 16.2 |
| �� | ���� | 3.2 g Na2CO3 | 20.0 | 25.1 |
A��Na2CO3��Һ������ķ�Ӧ�����ȷ�Ӧ
B��NaHCO3��Һ������ķ�Ӧ�Ƿ��ȷ�Ӧ
C��20.0 ��ʱ����3.2 g Na2CO3�ı�����Һ��35 mL�����Ϻ���¶Ƚ�����25.1 ��
D��20.0 ��ʱ����2.5 g NaHCO3�ı�����Һ��35 mL�����Ϻ���¶Ƚ�����16.2 ��
�����Ȼ�ѧ����ʽ�У���ȷ���ǣ� ��
| A�������ȼ����Ϊ 890.3 kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ�� CH4��g��+2O2��g��=CO2��g��+2H2O(g) ��H=-890��3 kJ��mol-1 |
| B��500�桢30MPa �£��� 0��5mol N2��g���� 1��5molH2��g�������ܱ������г�ַ�Ӧ���� NH3��g������ 19��3 kJ�����Ȼ�ѧ����ʽΪ�� N2��g��+3H2��g��  2NH3��g�� ��H = -38��6 kJ��mol-1 2NH3��g�� ��H = -38��6 kJ��mol-1 |
| C��HCl �� NaOH ��Ӧ���к��ȡ�H =" -57.3" kJ��mol-1�� �� H2SO4�� Ca��OH��2��Ӧ���к��� ��H = 2����-57��3��kJ��mol -1 |
| D���� 101 kPa ʱ��2gH2��ȫȼ������Һ̬ˮ���ų� 285��8kJ ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ 2H2(g)+O2(g)=2H2O��1����H = -571��6 kJ��mol-1 |
��ѧ��ӦA2 �� B2 �� 2AB�������仯��ͼ��ʾ��������˵����ȷ����( )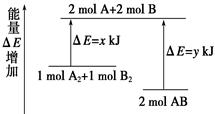
| A���÷�Ӧ�����ȷ�Ӧ |
| B������1 mol A��A����1 mol B��B���ܷų�x kJ������ |
| C������2 mol A��B����Ҫ����y kJ������ |
| D��2 mol AB������������1 mol A2��1 mol B2�������� |
���з�Ӧ����������ԭ��Ӧ���������ȷ�Ӧ���ǣ� ��
| A����Ƭ��ϡ���ᷴӦ | B��Ba��OH��2?8H2O��NH4Cl��Ӧ |
| C�����ȵ�̿��CO2��Ӧ | D��������O2��ȼ�� |
δ������Դ���ص�����Դ�ḻ����ʹ��ʱ�Ի�������Ⱦ����Ⱦ��С���ҿ������������з���δ������Դ������(����)
����Ȼ������ú���ۺ��ܡ���ʯ�͡���̫���ܡ����������ܡ��߷��ܡ�������
| A���٢ڢۢ� | B���ݢޢߢ� | C���ۢݢޢߢ� | D���ۢܢݢޢߢ� |
