题目内容
【题目】下列有关说法正确的是
A. 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B. 等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C. 0.1 mol·L-1NH4Cl溶液加水稀释,![]() 的值减小
的值减小
D. 对于反应2SO2+O2![]() 2SO3,使用催化剂能加快反应速率和提高SO2的平衡转化率
2SO3,使用催化剂能加快反应速率和提高SO2的平衡转化率
【答案】AC
【解析】A、铜、铁、电解质构成原电池,铁做负极,镀铜铁制品镀层受损后,铁更容易生锈,选项A正确;B、等物质的量浓度的CH3COOH溶液和HCl溶液中后者氢离子浓度较大,抑制水的电离程度较大,水的电离程度较小,选项B错误;C、0.1 mol/LNH4Cl溶液加水稀释,水解程度增大,![]() 的值减小,选项C正确;D、使用催化剂能加快反应速率但不能使平衡移动,故无法提高SO2的平衡转化率,选项D错误。答案选AC。
的值减小,选项C正确;D、使用催化剂能加快反应速率但不能使平衡移动,故无法提高SO2的平衡转化率,选项D错误。答案选AC。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
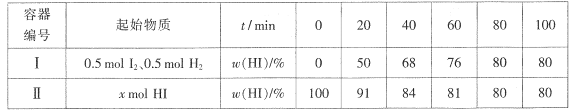
优化作业上海科技文献出版社系列答案【题目】合成氨的反应为N2+3H2![]() 2NH3+Q。下表是某次反应时NH3的浓度变化:
2NH3+Q。下表是某次反应时NH3的浓度变化:
时间(min) | 0 | 5 | 10 | 15 | 20 |
c(NH3)(mol/L) | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
完成下列填空:
(1)由表中数据计算0~10 min时,用H2表示的平均反应速率为________________。降低温度,反应的平衡常数将______________(填“增大”、“减小”或“不变”)。若要增大反应速率且提高H2利用率,可采取的措施有________________。
(2)若反应中气体混合物的密度保持不变,能否说明该反应已经达到平衡状态?并说明理由。____________________________________________________________________
(3)用右图所示装置进行有关氨气性质的实验,挤出胶头滴管中的水,打开止水夹后的实验现象是_____________。

(4)氨气溶于水后溶液显碱性的原因是(用方程式表示)____________________________________________。若在氨水中逐滴滴加盐酸,则溶液的pH将__________(填“增大”、“减小”或“不变”);当恰好完全反应时,则c(NH4+)________c(Cl-)(填“>”、“<”或“=”)。