题目内容
【题目】合成氨的反应为N2+3H2![]() 2NH3+Q。下表是某次反应时NH3的浓度变化:
2NH3+Q。下表是某次反应时NH3的浓度变化:
时间(min) | 0 | 5 | 10 | 15 | 20 |
c(NH3)(mol/L) | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
完成下列填空:
(1)由表中数据计算0~10 min时,用H2表示的平均反应速率为________________。降低温度,反应的平衡常数将______________(填“增大”、“减小”或“不变”)。若要增大反应速率且提高H2利用率,可采取的措施有________________。
(2)若反应中气体混合物的密度保持不变,能否说明该反应已经达到平衡状态?并说明理由。____________________________________________________________________
(3)用右图所示装置进行有关氨气性质的实验,挤出胶头滴管中的水,打开止水夹后的实验现象是_____________。

(4)氨气溶于水后溶液显碱性的原因是(用方程式表示)____________________________________________。若在氨水中逐滴滴加盐酸,则溶液的pH将__________(填“增大”、“减小”或“不变”);当恰好完全反应时,则c(NH4+)________c(Cl-)(填“>”、“<”或“=”)。
【答案】 0.066mol/(L·min) 增大 增大氮气的浓度、加压 不能,题目中没有指明是恒容容器还是恒压容器 烧杯中的水面下降;烧瓶中产生喷泉,出现红褐色沉淀 NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-(或分步书写) 减小 <
NH4++OH-(或分步书写) 减小 <
【解析】(1)由表中数据可知0~10 min时生成氨气是0.44mol/L,则消耗氢气是0.66mol/L,所以用H2表示的平均反应速率为0.66mol/L÷10min=0.066mol/(L·min)。正反应放热,降低温度平衡正向移动,反应的平衡常数将增大。正反应是放热的体积减小的可逆反应,若要增大反应速率且提高H2利用率,可采取的措施有增大氮气的浓度、加压等。(2)由于题目中没有指明是恒容容器还是恒压容器,所以若反应中气体混合物的密度保持不变,不能说明该反应已经达到平衡状态;(3)氨气极易溶于水,氨水能与氯化铁反应生成氢氧化铁沉淀,因此挤出胶头滴管中的水,打开止水夹后的实验现象是烧杯中的水面下降;烧瓶中产生喷泉,出现红褐色沉淀。(4)氨气溶于水后溶液显碱性的原因是一水合氨电离出氢氧根,方程式为NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-。若在氨水中逐滴滴加盐酸,中和氢氧根,氢离子浓度增大,则溶液的pH将减小;当恰好完全反应时铵根水解溶液显酸性,则溶液中c(NH4+)<c(Cl-)。
NH4++OH-。若在氨水中逐滴滴加盐酸,中和氢氧根,氢离子浓度增大,则溶液的pH将减小;当恰好完全反应时铵根水解溶液显酸性,则溶液中c(NH4+)<c(Cl-)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验方案的设计与评价合理的是 (_____)
A | B | C | D |
|
|
|
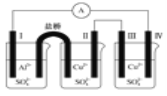
Ⅰ为Al电极,其他均为Cu电极 |
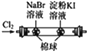
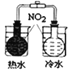
| 验证氧化性:Cl2>Br2>I2 | 验证温度对平衡移动的影响 | 电子流动方向:电极Ⅳ→A→电极Ⅰ |
A. A B. B C. C D. D