题目内容
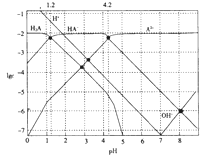
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 10-5 | K1=4×10-7 K2=4×10-11 | 10-8 |
请回答下列问题:
(1)a.CH3COOH、b.H2CO3、c.HClO的酸性由强到弱的顺序为___。(填字母)
(2)物质的量浓度均为0.1mol/L的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是___(填字母)
(3)常温下0.1mol/LCH3COOH溶液加水稀释过程中,下列各项中数值变大的是___(填字母)
A.c(H+) B.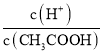 C.c(H+)·c(OH-)
C.c(H+)·c(OH-)
D.![]() E.
E.![]() F.
F.![]()
(4)25℃时,H2SO3![]() HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=___。
HSO3-+H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO3-)=0.1mol/L的NaHSO3溶液中c(H2SO3)=___。
【答案】a>b>c a<d<c<b BD 0.01mol/L
【解析】
(1)酸的电离平衡常数越大,酸的酸性越强;
(2)酸的电离平衡常数越大,酸的酸性越强,其对应的酸根离子结合氢离子的能力越弱;
(3)加水稀释促进醋酸电离,醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+)、c(CH3COOH)、c(CH3COO-)都减小,但是c(OH-)增大;
升高温度促进醋酸电离,溶液中c(H+)、c(CH3COO-)增大,c(CH3COOH)、c(OH-)减小;
(4)根据亚硫酸第一步电离平衡常数计算亚硫酸浓度。
(1)酸的电离平衡常数越大,酸的酸性越强,CH3COOH、H2CO3、HClO电离平衡常数依次减小,则酸性强弱顺序是CH3COOH>H2CO3>HClO,故答案为:a>b>c;
(2)酸的电离平衡常数越大,酸的酸性越强,其对应的酸根阴离子结合氢离子的能力越弱,酸性强弱顺序是CH3COOH>H2CO3>HClO>HCO3-,所以结合氢离子能力强弱顺序是CO32->ClO->HCO3->CH3COO-,结合氢离子的能力越强,溶液的碱性越强,pH越大,因此pH由小到大排列的顺序CH3COO-<HCO3-<ClO-<CO32-,即a<d<c<b,故答案为:a<d<c<b;
(3)加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+)、c(CH3COOH)、c(CH3COO-)都减小,但水的离子积常数不变,则c(OH-)增大。
A.加水稀释c(H+)减小,故A错误;B.加水稀释促进醋酸电离,n(H+)增大、n(CH3COOH)减小,所以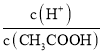 =
=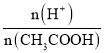 增大,故B正确;C.c(H+)c(OH-)=Kw,温度不变,水的离子积常数不变,故C错误;D.加水稀释,溶液中c(H+)减小,c(OH-)增大,则
增大,故B正确;C.c(H+)c(OH-)=Kw,温度不变,水的离子积常数不变,故C错误;D.加水稀释,溶液中c(H+)减小,c(OH-)增大,则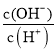 增大,故D正确;E.
增大,故D正确;E.![]() =Ka,温度不变,电离平衡常数不变,故E错误;F.
=Ka,温度不变,电离平衡常数不变,故E错误;F.![]() =
= ![]() =
=![]() ,温度不变,电离平衡常数和水的离子积常数不变,故F错误;故答案为:BD;
,温度不变,电离平衡常数和水的离子积常数不变,故F错误;故答案为:BD;
(4)电离常数Ka=1×10-2molL-1,则该温度下pH=3、c(HSO3-)=0.1molL-1的NaHSO3溶液中c(H2SO3)= 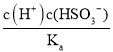 =
=![]() mol/L=0.01mol/L,故答案为:0.01mol/L。
mol/L=0.01mol/L,故答案为:0.01mol/L。

 阅读快车系列答案
阅读快车系列答案【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是______(填编号)。
(2)若测定结果偏高,其原因可能是_____________(填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后又用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(3)判断滴定终点的现象是______________________。
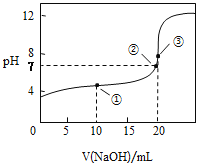
(4)如图是某次滴定时的滴定管中的液面,其读数为________mL。
![]()
(5)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |