题目内容
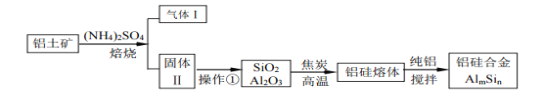
【题目】铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下:

(1)请用离子方程式表示以上工艺流程中第①步反应:___________________ 。
(2)写出以上工艺流程中第③步反应的化学方程式:______________________。
(3)金属铝与氧化铁混合点燃,会发生剧烈的反应。该反应的化学方程式 _____________。请举一例该反应的用途______________________。
(4)电解熔融氧化铝制取金属铝,若有0.6 mol电子发生转移,理论上能得到金属铝的质量是 _____。
【答案】(1)Al2O3+2OH-=2AlO2-+H2O
(2)NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3或2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3
(3)2Al+Fe2O3![]() 2Fe+Al2O3焊接钢轨(4)5.4g
2Fe+Al2O3焊接钢轨(4)5.4g
【解析】
试题分析:(1)Al2O3和氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O;
(2)向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀和碳酸氢钠,发生的反应化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(3)金属铝在高温下可以和氧化铁发生铝热反应:2Al+Fe2O3![]() 2Fe+Al2O3,获得金属铁,铁以铁水的形式生成,这样可以来焊接钢轨;
2Fe+Al2O3,获得金属铁,铁以铁水的形式生成,这样可以来焊接钢轨;
(4)电解熔融氧化铝制取金属铝2Al2O3![]() 4Al+3O2↑,反应转移电子为12mol,若有0.6mol电子发生转移,则能得到金属铝的质量是
4Al+3O2↑,反应转移电子为12mol,若有0.6mol电子发生转移,则能得到金属铝的质量是![]() =5.4g。
=5.4g。

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目