题目内容
【题目】铝硅合金材料性能优良。铝土矿(含30%SiO2、40.8% Al2O3、和少量的 Fe2O3等)干法制取该合金的工艺如下:
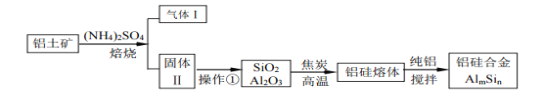
(1)铝硅合金中若含有铁,会影响其抗腐蚀性能,原因是_____________________
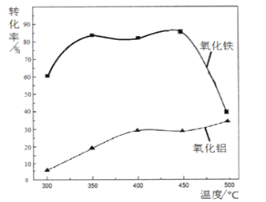
(2)焙烧除铁反应时,Fe2O3转化为NH4Fe(SO4 )2,Al2O3 少部分发生类似反应,写出Fe2O3反应的化学方程式:_____________________。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜的焙烧温度是________________
(3)若操作①所得的溶液中加入过量的NaOH溶液,含铝微粒发生的离子反应方程式是:_______________________。
(4)用焦炭还原SiO2、Al2O3会产生SiC等中间体。写出中间体SiC再与Al2O3生成硅、铝单质的化学反应方程式,_________________________。
(5)已知25℃ Ksp[Al(OH)3]=1.0×10-33 , Ksp[Fe(OH)3]=4.0×10-38,向FeCl3和AlCl3的混合溶液中逐滴滴入NaOH溶液,生成Al(OH)3和Fe(OH)3 沉淀,当两种沉淀共存时,上层清液中c(Al3+):c(Fe3+)==___________。
【答案】(1)铁与铝构成原电池,加快铝的腐蚀;
(2)4(NH4)2SO4+Fe2O3![]() 2NH3Fe(SO4)2+3H2O+6NH3↑;350℃;
2NH3Fe(SO4)2+3H2O+6NH3↑;350℃;
(3)Al3++4OH-=AlO2-+2H2O;
(4)3SiC+Al2O3![]() 3Si+2Al+3CO;(5)2.5×104。
3Si+2Al+3CO;(5)2.5×104。
【解析】
试题分析:(1)铝比铁活泼,构成原电池,铝作负极,铁作正极,加快铝的腐蚀速率;(2)Fe2O3→NH4Fe(SO4)2,化合价没发生变化,因此产生的气体是NH3,因此反应反应方程式为:4(NH4)2SO4+Fe2O3![]() 2NH3Fe(SO4)2+3H2O+6NH3↑;根据信息制备铝硅合金,氧化铁是杂质,因此选择氧化铁转化率高,氧化铝转化率较低的温度,即350℃;(3)根据信息氧化铝也能发生类似氧化铁的反应,即生成NH4Al(SO4)2,氢氧化铝表现两性,加入过量的NaOH,发生的反应是Al3++4OH-=AlO2-+2H2O;(4)C和SiO2发生反应生成CO,以及题目所给信息,发生反应是3SiC+Al2O3
2NH3Fe(SO4)2+3H2O+6NH3↑;根据信息制备铝硅合金,氧化铁是杂质,因此选择氧化铁转化率高,氧化铝转化率较低的温度,即350℃;(3)根据信息氧化铝也能发生类似氧化铁的反应,即生成NH4Al(SO4)2,氢氧化铝表现两性,加入过量的NaOH,发生的反应是Al3++4OH-=AlO2-+2H2O;(4)C和SiO2发生反应生成CO,以及题目所给信息,发生反应是3SiC+Al2O3![]() 3Si+2Al+3CO;(5)根据Ksp[Al(OH)3]=c(Al3+)×c3(OH-),Ksp[Fe(OH)3]=c(Fe3+3+)×c3(OH-)两式相比得到,c(Al3+)/c(Fe3+)=Ksp[Al(OH)3]/Ksp[Fe(OH)3]=2.5×104。
3Si+2Al+3CO;(5)根据Ksp[Al(OH)3]=c(Al3+)×c3(OH-),Ksp[Fe(OH)3]=c(Fe3+3+)×c3(OH-)两式相比得到,c(Al3+)/c(Fe3+)=Ksp[Al(OH)3]/Ksp[Fe(OH)3]=2.5×104。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】 研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用。
⑴已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJ·mol-1
CO(g)+3H2(g) △H1=+206.1kJ·mol-1
②2H2(g)+CO(g)![]() CH3OH(l) △H2=-128.3kJ·mol-1
CH3OH(l) △H2=-128.3kJ·mol-1
③2H2(g)+O2(g)![]() 2H2O(g) △H3=-483.6kJ·mol-1
2H2O(g) △H3=-483.6kJ·mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为 。
⑵利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/ mol·L-1 | H2O初始浓度/ mol·L-1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2 K3(填“>”、“<”或“=”)。
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为 。
⑶ 科学家提出由CO2制 取 C的太阳能工艺如图1所示。
①“重整系统发生的反应中n(FeO):n(CO2)=6:1,则Fe xOy的化学式为______________。
②“热分解系统”中每分解l mol Fe xOy,转移电子的物质的量为___________。


图1 图2
⑷pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。若某溶液中溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。如图2为25℃时H2CO3溶液的pC-pH图。请回答下列问题 (若离子浓度小于10-5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3-、CO32-____________(填“能”或“不能”)大量共存。
②求H2CO3一级电离平衡常数的数值Ka1=________________。
③人体血液里主要通过碳酸氢盐缓冲体系![]() 可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的
可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的![]() 最终将_________。
最终将_________。
A.变大 B.变小 C.基本不变 D.无法判断

