题目内容
某学生为了探究Zn与盐酸反应过程中的速率变化,在100mL稀盐酸中加入足量的Zn粉,用排水集气法收集反应放出的H2,实验记录如下(累计值):
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大 ,你认为原因是 .
(2)4~5min时间段的反应速率最小,你认为原因是 .
(3)求2~3min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)v(HCl)= .
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
(2)4~5min时间段的反应速率最小,你认为原因是
(3)求2~3min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)v(HCl)=
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:(1)根据表中数据判断单位时间内气体体积变化,体积变化越大,反应速率越大;
(2)随着反应的进行,溶液浓度逐渐减小,反应速率逐渐减小;
(3)根据体积计算物质的量,进而计算浓度,结合v=
计算反应速率.
(2)随着反应的进行,溶液浓度逐渐减小,反应速率逐渐减小;
(3)根据体积计算物质的量,进而计算浓度,结合v=
| △c |
| △t |
解答:
解:(1)从表中数据看出2 min~3 min收集的氢气比其他时间段多,反应速率最大,虽然反应中c(H+)下降,但主要原因是Zn置换H2的反应是放热反应,温度升高,
故答案为:2~3;Zn与盐酸反应放热,温度越高,反应速率越大;
(2)4 min~5 min收集的氢气最少,反应速率最小,虽然反应中放热,但主要原因是c(H+)下降,反应物浓度越低,反应速率越小,故答案为:H+浓度变小;
(3)2~3 min生成氢气的体积是112 mL,设需要盐酸的物质的量为xmol,
Zn+2HCl=ZnCl2 +H2 ↑
2 mol 22.4L
xmol 0.112L
x=0.01
所以△c(HCl )=
=0.1mol/L.
所以v(HCl )=
=0.1mol/(L.min),
故答案为:0.1mol?L-1?min-1.
故答案为:2~3;Zn与盐酸反应放热,温度越高,反应速率越大;
(2)4 min~5 min收集的氢气最少,反应速率最小,虽然反应中放热,但主要原因是c(H+)下降,反应物浓度越低,反应速率越小,故答案为:H+浓度变小;
(3)2~3 min生成氢气的体积是112 mL,设需要盐酸的物质的量为xmol,
Zn+2HCl=ZnCl2 +H2 ↑
2 mol 22.4L
xmol 0.112L
x=0.01
所以△c(HCl )=
| 0.01mol |
| 0.1L |
所以v(HCl )=
| 0.1mol/L |
| 1min |
故答案为:0.1mol?L-1?min-1.
点评:本题主要考查化学反应速率的影响因素,难度不大,需要注意的是反应过程中浓度以及温度的变化,注重基础知识的积累.

练习册系列答案
相关题目
如图为铜-锌-稀硫酸构成的原电池示意图,下列说法错误的是( )
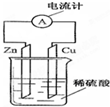

| A、负极反应式为:Zn-2e-═Zn2+ |
| B、正极反应式为:2H++2e-═H2↑ |
| C、电子由锌片通过导线流向铜片,再由铜片经电解质溶液流回锌片 |
| D、该装置能将化学能转变为电能 |
联合国把2011年定为“国际化学年”,纪念化学所取得的成就以及对人类文明的贡献.下列说法不正确的是( )
| A、化学是一门具有创造性的科学,是自然科学中创造新物质最多的科学领域 |
| B、现代化学的发展促进了社会的文明,提高了人类生活的质量 |
| C、化学合成的物质均有毒性,绝对不能食用 |
| D、普及化学知识,可以提高公众科学素养 |
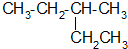 的系统命名为
的系统命名为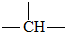 和一个-F,符合此要求的可能结构有
和一个-F,符合此要求的可能结构有