题目内容
9.以下关于晶体的说法中正确的是( )| A. | 晶体根据结构和性质只可分为分子晶体、原子晶体、离子晶体和金属晶体四大类 | |
| B. | 任何晶体中都含有化学键,如离子键、共价键、金属键、氢键等 | |
| C. | 含有阳离子的晶体一定是离子晶体 | |
| D. | 干冰和冰都属于分子晶体 |
分析 A.根据晶体的构成微粒将晶体分为四类;
B.单原子分子中不含化学键;
C.含有阳离子的晶体不一定是离子晶体可能为金属晶体;
D.干冰是二氧化碳晶体,由二氧化碳分子构成;冰是水晶体,由水分子构成.
解答 解:A.根据晶体的构成微粒将晶体分为分子晶体、原子晶体、离子晶体和金属晶体四类,故A错误;
B.单原子分子中不含化学键如稀有气体分子,氢键是分子间作用力而不是化学键,故B错误;
C.离子晶体中一定含有阳离子、阴离子,但含有阳离子的晶体不一定是离子晶体,如金属晶体,故C错误;
D.干冰是二氧化碳固体,是由二氧化碳分子构成,属于分子晶体,冰是水的固态形式,是由水分子构成,属于分子晶体,故D正确;
故选D.
点评 本题考查化学键与晶体之间关系,侧重考查分析判断能力,知道常见晶体类型及分类方法,易错选项是B,注意稀有气体中不含化学键,注意氢键属于分子间作用力,题目难度不大.

练习册系列答案
相关题目
20.下列离子方程式书写正确的是( )
| A. | 酸性高锰酸钾与少量双氧水反应:2MnO4-+3H2O2+6H+═2Mn2++3O2↑+6H2O | |
| B. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 向NaClO溶液中通入过量CO2;CO2+ClO-+H2O═HCO3-+HClO |
17.苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:
① △H=-116kJ•mol-1
△H=-116kJ•mol-1
②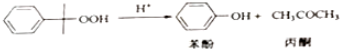 △H=-253k•mol-1
△H=-253k•mol-1

相关化合物的物理常数:
回答下列问题:(1)在反应器A中通入的X是氧气或空气.
(2)反应①和②分别在装置A和C中进行(填装置符号).
(3)在分解釜C中加入的Y为少量浓硫酸,其作用是催化剂,优点是用量少,缺点是腐蚀设备.
(4)反应②为放热(填“放热”或“吸热”)反应.反应温度控制在50-60℃,温度过高的安全隐患是温度过高会导致爆炸.
(5)中和釜D中加入的Z最适宜的是c(填编号)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(6)蒸馏塔F中的馏出物T和P分别为丙酮和苯酚,判断的依据是丙酮的沸点低于苯酚.
(7)用该方法合成苯酚和丙酮的优点是原子利用率高.
①
 △H=-116kJ•mol-1
△H=-116kJ•mol-1②
 △H=-253k•mol-1
△H=-253k•mol-1
相关化合物的物理常数:
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
(2)反应①和②分别在装置A和C中进行(填装置符号).
(3)在分解釜C中加入的Y为少量浓硫酸,其作用是催化剂,优点是用量少,缺点是腐蚀设备.
(4)反应②为放热(填“放热”或“吸热”)反应.反应温度控制在50-60℃,温度过高的安全隐患是温度过高会导致爆炸.
(5)中和釜D中加入的Z最适宜的是c(填编号)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(6)蒸馏塔F中的馏出物T和P分别为丙酮和苯酚,判断的依据是丙酮的沸点低于苯酚.
(7)用该方法合成苯酚和丙酮的优点是原子利用率高.
4.下列有关实验说法错误的是( )
| A. | 在0.1mol/LK2Cr2O4溶液中,滴加3滴浓硫酸,K2Cr2O4溶液颜色会改变 | |
| B. | 在做温度对反应速率的影响实验时,应该将Na2S2O3和稀硫酸分别加热到设定温度再混合 | |
| C. | 恒温恒容已达H2(g)+I2(g)?2HI(g)平衡的容器中,充入少量HI(g),容器中气体颜色不变 | |
| D. | 不断读取数据,直到出现下降,取最大值,即为中和反应反应热的测定中混合溶液的最高温度 |
14.下列关于有机物的命名中不正确的是( )
| A. | 2,2─二甲基戊烷 | B. | 3,4─二甲基辛烷 | C. | 2-甲基-3-丁炔 | D. | 1,3─丁二烯 |
18.分子式为C5H12O的某醇与溴化钠、硫酸混合加热得卤代烃,该卤代烃与强碱醇溶液共热后,不发生消去反应,该醇可能是( )
| A. | 1-戊醇 | B. | 3-戊醇 | ||
| C. | 2,2-二甲基-1-丙醇 | D. | 2-甲基-2-丁醇 |
 .
. .
.