题目内容
【题目】完成并分析下列化学原理
(1)在配制三氯化铁溶液时,为了防止发生水解,可以加入少量的________。
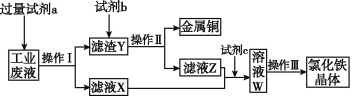
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是____________;
(3)除去CuCl2溶液中少量的FeCl3,加入的试剂可以是_____________。
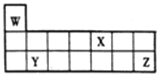
(4)在常温下,稀释等PH值的HCl、HF两种酸的稀溶液时,溶液pH随加水量的变化如图所示,能表示HF的稀释过程的曲线是:_____________

(5)amol·L-1(NH4 )2SO4溶液pH=5,其原因是_______(用相应的方程式说明)。
(6)有4种混合溶液,分别由等体积0.1 mol·L-1的两种溶液混合而成:①NH4Cl与 CH3COONa ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NH3·H2O(混合液呈碱性)。溶液中c(H+)由小到大的顺序为:(填混合溶液的编号)____________
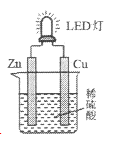
(7)在做Zn与稀H2SO4反应制取H2的实验中,向溶液中滴加几滴CuSO4溶液,反应放出H2速度加快的原因是:__________________________
【答案】稀盐酸或稀HCl Al2O3 或氧化铝 氧化铜、氢氧化铜、碳酸铜、碱式碳酸铜 HB NH4+ + H2O![]() NH3·H2O+H+ ④< ①< ③< ② 形成锌—铜—稀硫酸原电池,加快反应速率
NH3·H2O+H+ ④< ①< ③< ② 形成锌—铜—稀硫酸原电池,加快反应速率
【解析】
(1)三氯化铁为强酸弱碱盐,铁离子水解呈酸性;
(2)铝离子水解生成的盐酸为挥发性酸,蒸干得到氢氧化铝,再灼烧分解生成氧化铝;
(3)FeCl3 + 3H2O ![]() Fe(OH)3 + 3HCl,加入的试剂要消耗HCl而使平衡正向移动,使Fe(OH)3 变为沉淀过滤除去,但不能引入新杂质;
Fe(OH)3 + 3HCl,加入的试剂要消耗HCl而使平衡正向移动,使Fe(OH)3 变为沉淀过滤除去,但不能引入新杂质;
(4)稀释等PH值的HCl、HF两种酸的稀溶液时,溶液pH变化大的酸性较强,所以HA的酸性强,HB的酸性弱,;
(5)(NH4 )2SO4是强酸弱碱盐,NH4+水解显酸性;
(6)酸性越强,pH越小;
(7)形成锌—铜—稀硫酸原电池,加快反应速率。
(1)三氯化铁为强酸弱碱盐,铁离子水解呈酸性,配制三氯化铁溶液时,要抑制铁离子水解,加少量的盐酸,故答案为:稀盐酸或稀HCl;
(2)铝离子水解生成的盐酸为挥发性酸,蒸干得到氢氧化铝,再灼烧分解生成氧化铝,故答案为:Al2O3 或氧化铝;
(3)FeCl3 + 3H2O ![]() Fe(OH)3 + 3HCl,加入的试剂要消耗HCl而使平衡正向移动,使Fe(OH)3 变为沉淀过滤除去,但不能引入新杂质,故答案为:氧化铜、氢氧化铜、碳酸铜、碱式碳酸铜;
Fe(OH)3 + 3HCl,加入的试剂要消耗HCl而使平衡正向移动,使Fe(OH)3 变为沉淀过滤除去,但不能引入新杂质,故答案为:氧化铜、氢氧化铜、碳酸铜、碱式碳酸铜;
(4)稀释等PH值的HCl、HF两种酸的稀溶液时,溶液pH变化大的酸性较强,所以HA的酸性强,表示HF的稀释过程的曲线是HB;故答案为:HB;
(5)(NH4 )2SO4是强酸弱碱盐,NH4+水解显酸性,水解的离子方程式为NH4+ + H2O![]() NH3·H2O+H+,故答案为:NH4+ + H2O
NH3·H2O+H+,故答案为:NH4+ + H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(6)酸性越强,pH越小,四种混合物中,②NH4Cl与HCl的pH最小,④NH4Cl与NH3·H2O的pH最大,①NH4Cl与 CH3COONa显中性,③NH4Cl与NaCl显酸性,故pH大小关系为:②<③<①<④,c(H+)=10-PH,c(H+)越大,pH越小,故c(H+)由小到大的顺序为④< ①< ③< ②,故答案为:④< ①< ③< ②;
(7)Zn与稀H2SO4反应中滴加几滴CuSO4溶液,能置换出一定量的铜,在溶液中形成
形成锌—铜—稀硫酸原电池,加快反应速率,故答案为: 形成锌—铜—稀硫酸原电池,加快反应速率。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案