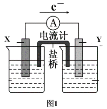
题目内容
【题目】SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究。已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图示装置进行实验。(部分固定装置未画出)
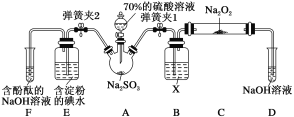
(1)关闭弹簧夹2,打开弹簧夹1,注入硫酸溶液至浸没三颈烧瓶中的固体。若将带火星的木条放在D试管口处,木条不复燃,说明SO2与Na2O2反应无O2生成,可能发生的化学方程式为____。
(2)关闭弹簧夹1,打开弹簧夹2,残余气体进入E、F中。E中的现象为___,E中反应的离子方程式为___。F中的现象为___。
【答案】Na2O2+SO2==Na2SO4 溶液蓝色褪去 SO2+I2+2H2O==2I-+SO42-+4H+ 红色变浅(或褪色)
【解析】
(1)过氧化钠具有氧化性,二氧化硫既有氧化性又有还原性,且属于酸性气体,根据过氧化钠和二氧化碳酸性氧化物之间的反应知道,过氧化钠可以和二氧化硫之间反应生成亚硫酸钠和氧气,但是氧气能将亚硫酸钠氧化为硫酸钠,所以可能发生的化学反应方程式为: Na2O2+SO2===Na2SO4;
(2)E中的离子方程式为:![]() ,该反应中二氧化硫为还原剂,碘离子为还原产物,氧化还原反应中,还原剂的还原性强于还原产物,能说明
,该反应中二氧化硫为还原剂,碘离子为还原产物,氧化还原反应中,还原剂的还原性强于还原产物,能说明![]() 还原性弱于
还原性弱于![]() ,现象为:E中溶液蓝色褪去;酚酞在碱性溶液中为红色,F中反应为
,现象为:E中溶液蓝色褪去;酚酞在碱性溶液中为红色,F中反应为![]() ═
═![]() ,碱性减弱,所以F中红色变浅或褪色。
,碱性减弱,所以F中红色变浅或褪色。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】镧系为元素周期表中第ⅢB族、原子序数为5771的元素。
(1)镝Dy)的基态原子电子排布式为[Xe] 4f106s2,画出镝(Dy)原子价层电子排布图:____________.
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为____________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是_____填元素名称)。
几种镧系元素的电离能(单位:kJmol-1)
元素 | Ⅰ1 | Ⅰ2 | Ⅰ3 | Ⅰ4 |
Yb (镱) | 604 | 1217 | 4494 | 5014 |
Lu (镥) | 532 | 1390 | 4111 | 4987 |
La (镧) | 538 | 1067 | 1850 | 5419 |
Ce (铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为_______(用元素符号表示)。
②画出氨的最简单气态氢化物水溶液中存在的氢键:________(任写一种)。
③元素Al也有类似成键情况,气态氯化铝分子表示为((AlCl3)2,分子中A1原子杂化方式为_____,分子中所含化学键类型有 _______(填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中错原子位于面心和顶点,则PrO2 (二氧化镨)的晶胞中有_____个氧原子;已知晶胞参数为apm,密度为ρgcm-3,NA=_______(用含a、ρ的代数式表示)。