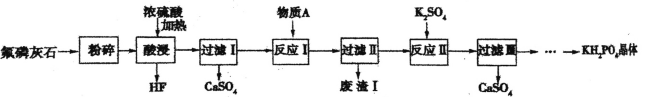
题目内容
【题目】镧系为元素周期表中第ⅢB族、原子序数为5771的元素。
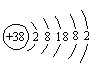
(1)镝Dy)的基态原子电子排布式为[Xe] 4f106s2,画出镝(Dy)原子价层电子排布图:____________.
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为____________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是_____填元素名称)。
几种镧系元素的电离能(单位:kJmol-1)
元素 | Ⅰ1 | Ⅰ2 | Ⅰ3 | Ⅰ4 |
Yb (镱) | 604 | 1217 | 4494 | 5014 |
Lu (镥) | 532 | 1390 | 4111 | 4987 |
La (镧) | 538 | 1067 | 1850 | 5419 |
Ce (铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为_______(用元素符号表示)。
②画出氨的最简单气态氢化物水溶液中存在的氢键:________(任写一种)。
③元素Al也有类似成键情况,气态氯化铝分子表示为((AlCl3)2,分子中A1原子杂化方式为_____,分子中所含化学键类型有 _______(填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中错原子位于面心和顶点,则PrO2 (二氧化镨)的晶胞中有_____个氧原子;已知晶胞参数为apm,密度为ρgcm-3,NA=_______(用含a、ρ的代数式表示)。
【答案】![]() 1s22s22p63s23p63d8 镧 O>N>H>Ce N-H…O(或N-H…N或O-H…N或O-H…O) sp3杂化 bd 8
1s22s22p63s23p63d8 镧 O>N>H>Ce N-H…O(或N-H…N或O-H…N或O-H…O) sp3杂化 bd 8 ![]()
【解析】
(1)镝(Dy)的基态原子外围价电子排布式为4f106s2,结合泡利原理、洪特规则画出排布图;
(2)Cu原子核外电子排布式为:1s22s22p63s23p63d104s1,先失去4s能级1个电子,再失去3d能级2个电子形成Cu3+;
(3)第三电离能与第一电离能、第二电离能相差越小,与第四电离能相差越大,第三个电子越容易失去,+3价的可能性越大;
(4)①同周期主族元素自左而右电负性增大,N、O在它们的氢化物中均表现负化合价,数目它们的电负性均大于氢元素的,一般非金属性越强,电负性越大;
②NH3的水溶液中,NH3分子之间形成氢键,水分子之间形成氢键,NH3与水分子之间形成2种氢键(N-H…O或O-H…N);
③气态氯化铝分子表示为(AlCl3)2,Al原子价电子数为3,与Cl原子已经全部成键,Al原子有1个空轨道,Cl原子有孤电子对,Al原子与Cl之间形成1个配位键,结构式为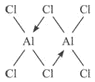 ;
;
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点,根据均摊法计算晶胞中Pr原子数目,再根据化学式中原子数目之比计算晶胞中O原子数目;结合晶胞中原子数目用阿伏伽德罗常数表示出晶胞质量,而晶胞质量也等于晶胞体积与密度乘积,联立计算。
(1)镝(Dy)的基态原子外围电子排布式为4f106s2,由泡利原理、洪特规则,外围价电子排布图为:![]() ;
;
(2)Cu原子核外电子排布式为:1s22s22p63s23p63d104s1,先失去4s能级1个电子,再失去3d能级2个电子形成Cu3+,基态时Cu3+的电子排布式为:1s22s22p63s23p63d8;
(3)第三电离能与第一电离能、第二电离能相差越小,第三个电子越容易失去,+3价的可能性越大,在上述表中La的I1+I2和I3最接近,I3与I4差距最大,故La元素最可能形成+3;
(4)①同周期主族元素自左而右电负性增大,N、O在它们的氢化物中均表现负化合价,数目它们的电负性均大于氢元素的,一般非金属性越强,电负性越大,电负性由大到小的顺序为:O>N>H>Ce;
②NH3的水溶液中,NH3分子之间形成氢键(N-H…N),水分子之间形成氢键(O-H…O),NH3与水分子之间形成2种氢键(N-H…O或O-H…N);
③气态氯化铝分子表示为(AlCl3)2,Al原子价电子数为3,与Cl原子已经全部成键,Al原子有1个空轨道,Cl原子有孤电子对,Al原子与Cl之间形成1个配位键,结构式为 ,Al是原子采取sp3杂化,含有的化学键有极性键、配位键,没有离子键、非极性键;
,Al是原子采取sp3杂化,含有的化学键有极性键、配位键,没有离子键、非极性键;
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点,则晶胞中Pr原子数目=8×![]() +6×
+6×![]() =4,而Pr原子与O原子数目之比为1:2,则晶胞中O原子数目为4×2=8,晶胞质量=
=4,而Pr原子与O原子数目之比为1:2,则晶胞中O原子数目为4×2=8,晶胞质量=![]() g=(a×10-10 cm)3×ρgcm-3,整理得NA=
g=(a×10-10 cm)3×ρgcm-3,整理得NA=![]() 。
。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案