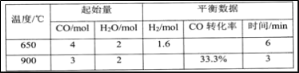
题目内容
【题目】A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应。
请回答下列问题:
(1)写出B、C、E元素的名称B_________、C___________、E____________;
(2)写出C、D两种元素形成的原子个数比为1:1的物质的电子式为_______________;
(3)可以验证C和F两种元素非金属性强弱的结论是(填编号)_________________;
①比较这两种元素的气态氢化物的沸点
②比较这两种元素的单质与氢气化合的难易程度
③比较这两种元素的气态氢化物的还原性
④比较这两种元素反应中得电子的多少
(4)向E的硝酸盐溶液中滴加过量D的最高价氧化物的水化物溶液,反应的离子方程式为____________。
(5)A、C、D、F四种元素可以形成两种酸式盐![]() 均由四种元素组成
均由四种元素组成![]() ,这两种酸式盐的化学式分别为_____、______,这两种酸式盐相互反应的离子方程式为______________________。
,这两种酸式盐的化学式分别为_____、______,这两种酸式盐相互反应的离子方程式为______________________。
【答案】氮 氧 铝 ![]() ②③ Al3++4OH—=AlO2—+2H2O NaHSO3 NaHSO4 H++HSO3—=H2O+SO2↑
②③ Al3++4OH—=AlO2—+2H2O NaHSO3 NaHSO4 H++HSO3—=H2O+SO2↑
【解析】
A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A为H;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N;F元素原子的最外层电子数是其次外层电子数的![]() ,则F为S;D与A同主族,且与F同周期,则D为Na;A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O,D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应,可知E为Al,以此解答该题。
,则F为S;D与A同主族,且与F同周期,则D为Na;A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O,D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应,可知E为Al,以此解答该题。
A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A为H;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N;F元素原子的最外层电子数是其次外层电子数的![]() ,则F为S;D与A同主族,且与F同周期,则D为Na;A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O,D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应,可知E为Al;
,则F为S;D与A同主族,且与F同周期,则D为Na;A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O,D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应,可知E为Al;
(1)由以上分析可知B为氮,C为氧,E为铝;
(2)C与D形成的原子个数比为1:1的化合物为Na2O2,电子式是![]() ;
;
(3)氧与硫同主族,从上到下非金属性在减弱,则非金属性O>S,元素的非金属性越强,在反应中越易得电子,但与得电子数目无关;越易与氢气发生化合反应,生成的氢化物越稳定,气态氢化物的还原性越弱,但与单质的熔沸点无关,故答案为:②③;
(4)向Al(NO3)3的溶液中加入过量NaOH溶液生成NaAlO2、NaNO3和水,发生反应的离子方程式为Al3++4OH—=AlO2—+2H2O;
(5)A、C、D、F可形成两种酸式盐为NaHSO3和NaHSO4,两者反应生成Na2SO4和SO2气体,发生反应的离子反应为HSO3-+H+═SO2↑+H2O。