题目内容
【题目】亚氯酸钠(NaC1O2)是重要漂白剂,探究小组开展如下实验。
实验I:用如图装置制取NaClO2。

已知:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaC1。
(1)检查整套装置气密性的操作是:首先____________,打开K1、K2,然后向A、E中加水没过干燥管下端,用酒精灯微热三颈烧瓶,若A、E处有气泡,停止加热,一段时间后,A、E干燥管内形成一段稳定的水柱,说明整套装置气密性良好。
(2)用50%双氧水配制30%H2O2溶液,需要的玻璃仪器除玻璃棒、烧杯外,还需要的仪器有________________ (填仪器名称)。
(3)装置C的作用是____________________________。
(4)己知装置B中的产物有C1O2气体,则装置D中反应生成NaClO2的化学方程式为________________________________________________。
(5)请补充完整从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;
②____________________;
③38℃~60℃热水洗涤;
④低于60℃干燥得到成品。
(6)实验结束时,打开K1,关闭K2,装置A的作用是________________________。
【答案】关闭分液漏斗活塞 胶头滴管、量筒 防止D 中溶液倒吸到 B 中(或安全瓶) 2ClO2+2NaOH+H2O2===2NaClO2+O2+2H2O 趁热过滤 吸收多余的ClO2(或 ClO2、SO2),防止污染空气。
【解析】
装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成ClO2和Na2SO4,装置C为安全瓶,装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,装置E为吸收多余的气体,防止污染空气,装置A是吸收B中剩余气体。
(1)组装好仪器后,检查整套装置气密性的操作是:关闭分液漏斗活塞,打开K1、K2,然后向A、E中加水没过干燥管下端,用酒精灯微热三颈烧瓶,若A、E处有气泡,停止加热,一段时间后,A、E干燥管内形成一段稳定的水柱,说明整套装置气密性良好;
(2)根据仪器用途选取仪器;
(3)装置C的作用是安全瓶,有防倒吸作用;
(4)装置D中ClO2和氢氧化钠、双氧水生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,据此书写;
(5)从装置D的溶液获得NaClO2晶体,需要蒸发结晶、趁热过滤、洗涤、干燥;
(6)实验结束时,打开K1,关闭K2,装置A的作用是:吸收多余的ClO2(或 ClO2、SO2),防止污染空气,故答案为:吸收多余的ClO2(或 ClO2、SO2),防止污染空气。
(1)组装好仪器后,检查整套装置气密性的操作是:关闭分液漏斗活塞,打开K1、K2,然后向A、E中加水没过干燥管下端,用酒精灯微热三颈烧瓶,若A、E处有气泡,停止加热,一段时间后,A、E干燥管内形成一段稳定的水柱,说明整套装置气密性良好。故答案为:关闭分液漏斗活塞;
(2)用50%双氧水配制30%的H2O2溶液,需要的仪器有量筒、烧杯、玻璃棒、胶体滴管,所以还需要量筒、胶头滴管;故答案为:胶头滴管、量筒;
(3)装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;故答案为:防止D 中溶液倒吸到 B 中(或安全瓶);
(4)装置D中ClO2和氢氧化钠、双氧水生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,溶液为碱性溶液,则发生的方程式为:2ClO2+2NaOH+H2O2===2NaClO2+O2+2H2O ,故答案为:2ClO2+2NaOH+H2O2===2NaClO2+O2+2H2O;
(5)从装置D的溶液获得NaClO2晶体,需要蒸发结晶、趁热过滤、洗涤、干燥操作,
故答案为:趁热过滤;
(6)吸收多余的ClO2(或 ClO2、SO2),防止污染空气,故答案为:吸收多余的ClO2(或 ClO2、SO2),防止污染空气。

【题目】回答下列问题:
(1)若金属钠等活泼金属着火时,应该用_______________来灭火。将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是________。
a.有气体生成 b.钠熔化成小球并在液面上游动
c.烧杯底部有银白色的金属钙生成 d.溶液变浑浊
(2)Na2CO3和NaHCO3是两种常见的钠盐。下列关于Na2CO3和NaHCO3性质的说法中,正确的是______________。
a.常温下,Na2CO3在水中的溶解度比NaHCO3小
b.相同质量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2前者多
c.可用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液
d. NaHCO3溶液中混有少量Na2CO3杂质可通入足量CO2除杂
(3)过氧化钠、过氧化镁都是重要的过氧化物。过氧化镁不溶于水,但易溶于稀酸,广泛用作胃药,治疗胃酸过多。试写出过氧化镁与胃酸反应的离子方程式:_____________。
(4)某无色稀溶液X中,可能含有Al3+、Cl-、Fe3+、Mg2+、NH4+中的某几种,向其中加入NaOH溶液时产生沉淀的物质的量(n)与加入NaOH溶液体积(V)的关系如下图所示。
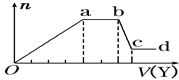
则X中一定含有的阳离子是_________,bc段反应的离子方程式为________。
(5)在1L某酸性溶液中离子浓度的分析结果如下表
离子 | Mg2+ | Al3+ | SO42 | Cl |
c/(mol/L) | 0.5×102 | 1.0×102 | 0.5×102 | 3.0×102 |
向该溶液中逐滴加入0.5 molL-1NaOH溶液至沉淀恰好不再溶解时,消耗NaOH体积为_____mL。