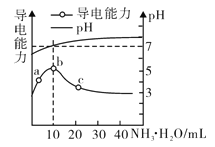
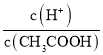题目内容
【题目】下列说法错误的是
A.向0.1molL-1的CH3COOH溶液中加入少量碳酸钙固体,溶液的pH增大
B.室温下,pH=4的NaHSO4溶液中,水电离出的H+浓度为1×10-10molL-1
C.浓度均为0.1molL-1的HCN溶液和NaCN溶液等体积混合(忽略体积变化),溶液中c(HCN)+c(CN-)=0.1molL-1
D.pH相同的①NH4Cl、②NH4Al(SO4)2、③(NH4)2SO4三种溶液的c(NH4+):②<③<①
【答案】D
【解析】
A.向0.1 mol/L的CH3COOH溶液中加入少量碳酸钙固体,醋酸浓度减小,溶液中氢离子浓度减小,溶液的pH增大,故A正确;
B.室温下,pH=4的NaHSO4溶液抑制了水的电离,溶液中氢氧根离子是水电离产生,则水电离出的c(H+)水=c(OH-)溶液=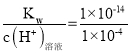 mol/L =1×1010 mol/L,故B正确;
mol/L =1×1010 mol/L,故B正确;
C.浓度均为0.1 mol/L的HCN溶液和NaCN溶液等体积混合(忽略体积变化),根据溶液中的物料守恒可得:c(HCN)+c(CN)=0.1 mol/L,故C正确;
D.①NH4Cl、③(NH4)2SO4中铵根离子正常水解,溶液中氢离子主要是铵根离子水解产生的,则pH相同时两溶液中铵根离子浓度相同;②NH4Al(SO4)2铝离子水解溶液呈酸性,若pH相同时,②中铵根离子浓度最小,所以三种溶液中铵根离子浓度大小为:①=③>②,故D错误;
答案选D。

【题目】一定条件下,可逆反应2A(g)![]() B(g)+3C(g),反应处于平衡状态的是( )
B(g)+3C(g),反应处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | v(A)=2mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
B | v(A)=2mol·L-1·min-1 | v(C)=2mol·L-1·min-1 |
C | v(A)=1mol·L-1·min-1 | v(B)=2mol·L-1·min-1 |
D | v(A)=1mol·L-1·min-1 | v(C)=1.5mol·L-1·min-1 |
A.AB.BC.CD.D