题目内容
【题目】常温下两种不同浓度的NaOH溶液,c(H+)分别为1×10-13 mol/L和1×10-10 mol/L。将此两溶液等体积混合后,所得溶液中的c(H+)是( )
A.1×(10-14+10-10) mol/LB.![]() mol/L
mol/L
C.2×10-13 mol/LD.2×10-14 mol/L
【答案】C
【解析】
对于NaOH溶液来说,溶液中OH-的浓度大于溶液中H+的浓度,要先计算溶液中c(OH-)。c(H+)为1×10-13 mol/LNaOH溶液中c(OH-)=0.1 mol/L;c(H+)为1×10-10 mol/L的NaOH溶液中c(OH-)=10-4 mol/L。将两种溶液等体积混合,假设每种溶液的体积为1 L,混合过程中溶液体积变化不计,则根据混合前后溶质的物质的量不变,可知混合溶液中c(OH-)=![]() =
=![]() mol/L,则该溶液中c(H+)=
mol/L,则该溶液中c(H+)=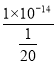 mol/L=2×10-13 mol/L,故合理选项是C。
mol/L=2×10-13 mol/L,故合理选项是C。

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目