��Ŀ����
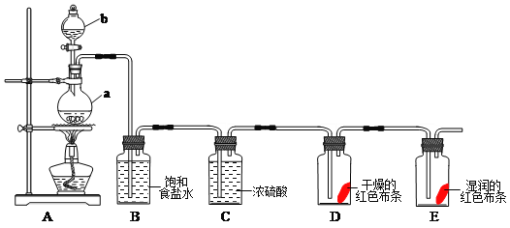
����Ŀ��Ϊ̽��ij������X (�����ֶ�����Ԫ�أ���ͬ�����£�X����Է���������������83.5��)����ɺ����ʣ�ij��ѧ��ȤС�����������ʵ�飬ͬ��ͬѹ�²��A�������B�Ķ�������������B��CΪ���ʡ�.
��ش���������:
(1)������X�Ļ�ѧʽΪ______�� ����C�ĵ���ʽΪ________
(2)������X�����������ȷֽ�Ļ�ѧ����ʽΪ________��
(3)ʵ���ҳ���ʪ���KI������ֽ��������C��д�����ӷ���ʽ_________ , ����__________
���𰸡�Cl2O6 ![]() Cl2O6
Cl2O6 ![]() 2ClO2�� +O2�� Cl2+2I-=2Cl-+I2 ��ֽ����ɫ
2ClO2�� +O2�� Cl2+2I-=2Cl-+I2 ��ֽ����ɫ
��������
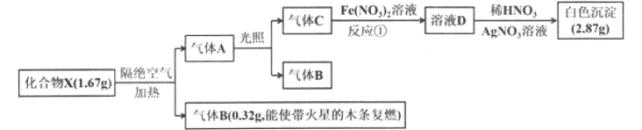
����B��ʹ�����ǵ�ľ����ȼ����BΪ������0.32g����Ϊ![]() 0.01mol������A���������·�Ӧ��������C������������C��������������Һ��Ӧ�õ�����ҺD�������ữ����������Һ��Ӧ���ɰ�ɫ��������ɫ����Ϊ�Ȼ����������֪����CΪ���������ݰ�ɫ�����Ȼ���������Ϊ2.87g����n(AgCl)=
0.01mol������A���������·�Ӧ��������C������������C��������������Һ��Ӧ�õ�����ҺD�������ữ����������Һ��Ӧ���ɰ�ɫ��������ɫ����Ϊ�Ȼ����������֪����CΪ���������ݰ�ɫ�����Ȼ���������Ϊ2.87g����n(AgCl)=![]() =0.02mol����n(Cl2)=0.01mol��ͬ��ͬѹ�²��A�������B�Ķ�������A�����ʵ���Ϊ0.02mol��������X (�����ֶ�����Ԫ�أ���ͬ�����£�X����Է���������������83.5��)����������������Ԫ�أ���Է�������Ϊ83.5
=0.02mol����n(Cl2)=0.01mol��ͬ��ͬѹ�²��A�������B�Ķ�������A�����ʵ���Ϊ0.02mol��������X (�����ֶ�����Ԫ�أ���ͬ�����£�X����Է���������������83.5��)����������������Ԫ�أ���Է�������Ϊ83.5![]() =167�����ʵ���Ϊ
=167�����ʵ���Ϊ![]() ��0.01molX �����������ȷ�Ӧ����0.02molA ��0.01mol��������0.02molA�к���Cl�����ʵ���Ϊ0.02mol����X��Ҳ����0.02molCl����X�к���O������Ϊ1.67g-0.02mol
��0.01molX �����������ȷ�Ӧ����0.02molA ��0.01mol��������0.02molA�к���Cl�����ʵ���Ϊ0.02mol����X��Ҳ����0.02molCl����X�к���O������Ϊ1.67g-0.02mol![]() 35.5g/mol=0.96g��n(O)=
35.5g/mol=0.96g��n(O)=![]() 0.06mol��N(Cl):N(O)= 0.02mol: 0.06mol=1:3��A�к�O�����ʵ���Ϊ0.06mol-0.01mol
0.06mol��N(Cl):N(O)= 0.02mol: 0.06mol=1:3��A�к�O�����ʵ���Ϊ0.06mol-0.01mol![]() 2=0.04mol��A��N(Cl):N(O)= 0.02mol: 0.04mol=1:2������������ʵ����ı�����������ԭ��Ӧ�ɵ�X�ķֽⷴӦΪCl2O6
2=0.04mol��A��N(Cl):N(O)= 0.02mol: 0.04mol=1:2������������ʵ����ı�����������ԭ��Ӧ�ɵ�X�ķֽⷴӦΪCl2O6 ![]() 2ClO2�� +O2������XΪCl2O6��AΪClO2���ݴ˷�����
2ClO2�� +O2������XΪCl2O6��AΪClO2���ݴ˷�����
����B��ʹ�����ǵ�ľ����ȼ����BΪ������0.32g����Ϊ![]() 0.01mol������A���������·�Ӧ��������C������������C��������������Һ��Ӧ�õ�����ҺD�������ữ����������Һ��Ӧ���ɰ�ɫ��������ɫ����Ϊ�Ȼ����������֪����CΪ���������ݰ�ɫ�����Ȼ���������Ϊ2.87g����n(AgCl)=
0.01mol������A���������·�Ӧ��������C������������C��������������Һ��Ӧ�õ�����ҺD�������ữ����������Һ��Ӧ���ɰ�ɫ��������ɫ����Ϊ�Ȼ����������֪����CΪ���������ݰ�ɫ�����Ȼ���������Ϊ2.87g����n(AgCl)=![]() =0.02mol����n(Cl2)=0.01mol��ͬ��ͬѹ�²��A�������B�Ķ�������A�����ʵ���Ϊ0.02mol��������X (�����ֶ�����Ԫ�أ���ͬ�����£�X����Է���������������83.5��)����������������Ԫ�أ���Է�������Ϊ83.5
=0.02mol����n(Cl2)=0.01mol��ͬ��ͬѹ�²��A�������B�Ķ�������A�����ʵ���Ϊ0.02mol��������X (�����ֶ�����Ԫ�أ���ͬ�����£�X����Է���������������83.5��)����������������Ԫ�أ���Է�������Ϊ83.5![]() =167�����ʵ���Ϊ
=167�����ʵ���Ϊ![]() ��0.01molX �����������ȷ�Ӧ����0.02molA ��0.01mol��������0.02molA�к���Cl�����ʵ���Ϊ0.02mol����X��Ҳ����0.02molCl����X�к���O������Ϊ1.67g-0.02mol
��0.01molX �����������ȷ�Ӧ����0.02molA ��0.01mol��������0.02molA�к���Cl�����ʵ���Ϊ0.02mol����X��Ҳ����0.02molCl����X�к���O������Ϊ1.67g-0.02mol![]() 35.5g/mol=0.96g��n(O)=
35.5g/mol=0.96g��n(O)=![]() 0.06mol��N(Cl):N(O)= 0.02mol: 0.06mol=1:3��A�к�O�����ʵ���Ϊ0.06mol-0.01mol
0.06mol��N(Cl):N(O)= 0.02mol: 0.06mol=1:3��A�к�O�����ʵ���Ϊ0.06mol-0.01mol![]() 2=0.04mol��A��N(Cl):N(O)= 0.02mol: 0.04mol=1:2������������ʵ����ı�����������ԭ��Ӧ�ɵ�X�ķֽⷴӦΪCl2O6
2=0.04mol��A��N(Cl):N(O)= 0.02mol: 0.04mol=1:2������������ʵ����ı�����������ԭ��Ӧ�ɵ�X�ķֽⷴӦΪCl2O6 ![]() 2ClO2�� +O2������XΪCl2O6��AΪClO2��
2ClO2�� +O2������XΪCl2O6��AΪClO2��
(1)������X�Ļ�ѧʽΪCl2O6�� ����CΪ�����������ʽΪ![]() ��
��
(2)������X�����������ȷֽ�Ļ�ѧ����ʽΪCl2O6 ![]() 2ClO2�� +O2����
2ClO2�� +O2����
(3)ʵ���ҳ���ʪ���KI������ֽ��������C��Ϊ���������⻯�������Ȼ��غ͵ⵥ�ʣ��������۱�������Ӧ�����ӷ���ʽΪCl2+2I-=2Cl-+I2, ����Ϊ��ֽ������

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����ͬ�¶��£������Ϊ0.25 L�����������ܱ������з������淴Ӧ��N2(g)��3H2(g) ![]() 2NH3(g)����H����92.6 kJ��mol��1��ʵ������ʼ��ƽ��ʱ���й��������±���ʾ��
2NH3(g)����H����92.6 kJ��mol��1��ʵ������ʼ��ƽ��ʱ���й��������±���ʾ��
������� | ��ʼʱ�����ʵ����ʵ���/mol | ��ƽ��ʱ��ϵ�����ı仯 | ||
N2 | H2 | NH3 | ||
�� | 1 | 3 | 0 | �ų�������23.15 kJ |
�� | 0.9 | 2.7 | 0.2 | �ų�������Q |
���������������
A.�����١����з�Ӧ��ƽ�ⳣ�����
B.ƽ��ʱ������������NH3�����������Ϊ![]()
C.�������д�ƽ��ʱ�ų�������Q��23.15 kJ
D.�������ٵ����Ϊ0.5 L����ƽ��ʱ�ų�������С��23.15 kJ
����Ŀ���ں��������£���Ӧ��2SO2 (g) + O2 (g) ![]() 2SO3(g) ��H =��QkJ��mol��1�������������·ֱ���������ͷ�Ӧ�ų������� ( Q>0 )���±����У�
2SO3(g) ��H =��QkJ��mol��1�������������·ֱ���������ͷ�Ӧ�ų������� ( Q>0 )���±����У�
���� | SO2 (mol) | O2(mol) | N2(mol) | Q(kJ��mol��1) |
�� | 2 | 1 | 0 | Q1 |
�� | 1 | 0.5 | 0 | Q2 |
�� | 1 | 0.5 | 1 | Q3 |
�����������ݣ�����������ȷ���ǣ� ��
A. �����������·�Ӧ����lmol SO3�������Q/2 kJ B. 2Q3 <2Q2=Q1<Q
C. Ql =2Q2= 2Q3 = Q D. 2Q2 = 2Q3 < Q1 < Q