题目内容
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g) ![]() 2XY3(g) △H=-92.6kJ/mol
2XY3(g) △H=-92.6kJ/mol
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol/L
C. 容器②中反应达到平衡时放出的热量为23.15kJ
D. 若容器①体积为0.20 L,则达平衡时放出的热量小于23.15 kJ
【答案】B
【解析】A. 平衡常数只与温度有关,温度不变,同一反应的平衡常数不变,故A错误;B. ①容器中放出23.15kJ的热量,则由反应方程式可知,生成氨气的物质的量为:23.15kJ÷92.6kJ/mol=0.5mol,根据三段式法有:
X2(g) + 3Y2(g) ![]() 2XY3(g)
2XY3(g)
起始(mol): 1 3 0
转化(mol): 0.25 0.75 0.5
平衡(mol): 0.75 2.25 0.5
可知平衡时①容器中X2、Y2和XY3的物质的量分别为0.75mol、2.25mol和0.5mol,将②按化学计量数之比换算成左边,与①对应物质的物质的量相等,恒温恒容下,两平衡是完全等效平衡,所以平衡时②容器中X2、Y2和XY3的物质的量也分别为0.75mol、2.25mol和0.5mol,此时XY3的物质的量浓度均为0.5mol÷0.25L=2mol/L,故B正确;C. 起始时容器②中XY3的物质的量浓度为0.8mol÷0.25L=3.2mol/L,由B计算可知容器②中反应达到平衡时,XY3的物质的量浓度为2mol/L,则起始时②的反应向逆反应方向进行,反应过程需要吸热,故C错误;D. 若容器①体积为0.20L,相当于减小体积,增大压强,平衡向正反应方向移动,放出热量多,故D错误;答案选B。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】一同学用某种粗盐进行提纯实验,步骤见下图.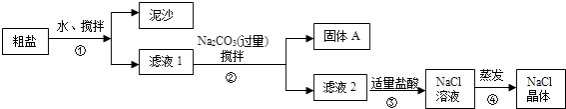
请回答:
(1)步骤①和②的操作名称是 .
(2)步骤③判断加入盐酸“适量”的方法是;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止 , 当蒸发皿中有较多量固体出现时,应 , 用余热使水分蒸干.
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 |
| 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含 | 取少量固体A于试管中,先滴入 , 再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, |
| 猜想Ⅲ成立 |