��Ŀ����
����Ŀ������1807�껯ѧ�Ҵ�ά�õ���������������Ƶ��ƣ�4NaOH�������� ![]() 4Na��O2����2H2O��������������������������������������Ҳ�Ƶ��ƣ���Ӧԭ��Ϊ3Fe��4NaOH��������
4Na��O2����2H2O��������������������������������������Ҳ�Ƶ��ƣ���Ӧԭ��Ϊ3Fe��4NaOH�������� ![]() Fe3O4��2H2����4Na���������й�˵����ȷ����
Fe3O4��2H2����4Na���������й�˵����ȷ����
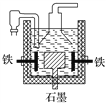
A. ������������������ƣ����������ĵ缫��ӦΪ2OH����2e��===H2����O2��
B. ���������˷�����ԭ�����������Ļ�ԭ�Ա���ǿ
C. ����ά������������˷��Ƶõ������ƣ�������Ӧ��ת�Ƶĵ�������Ҳ��ͬ
D. Ŀǰ��ҵ�ϳ��õ�������Ȼ��Ʒ�����������ͼ����������ʯīΪ��������Ϊ����
���𰸡�D
��������A���������NaOHʱ������OH���ŵ�����O2��H2O��A������B���ƵĻ�ԭ��ǿ������B������C�����Ƶ�4 mol�ƣ����ݷ���ʽ��֪ת�Ƶ������ֱ�Ϊ4 mol��8 mol��C������D����������Ȼ�������ʱʯīΪ��������Ϊ������D��ȷ����ѡD��

��ϰ��ϵ�д�
�����Ŀ