题目内容
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol,
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ/mol,
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为______________________________________________________。
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
CH3OH(g)+H2O(g)。某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
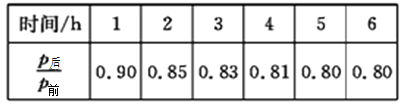
①用H2表示的前2h的平均反应速率v(H2)=_________。
②该温度下,CO2的平衡转化率为______________。
(3)在300℃、8MPa下,将CO2和H2按物质的量之比1:3通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)的关系。
C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)的关系。
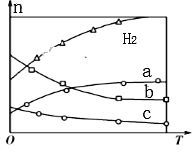
①该反应的△H_______0(填“>”或“<”)。
②曲线c表示的物质为______(填化学式)。
【答案】CH4(g) + 2H2O(g) = CO2(g) + 4H2(g) △H = + 165.0 kJ/mol 0.225 mol·L-1·h-1(或13.5 mol·L-1·min-1) 40% 1/48或0.02 < C2H4
【解析】
(1)已知:①CH 4(g)+H 2 O(g)═CO(g)+3H 2(g)△H=+206.2kJ/mol
②CH 4(g)+CO 2(g)═2CO(g)+2H 2(g)△H=+247.4kJ/mol
由盖斯定律,①×2-②得CH 4(g)+2H 2 O(g)═CO 2(g)+4H 2(g)△H=+165.0 kJ/mol,
故答案为:CH 4(g)+2H 2 O(g)═CO 2(g)+4H 2 (g)△H=+165.0 kJ/mol;
(2)①恒温恒容时,气体压强之比等于其物质的量之比,2h时P后/P前=0.85,
设消耗CO2的物质的量为x mol。
CO2 ( g) + 3H2 (g)![]() CH3OH(g)+ H2O(g) V
CH3OH(g)+ H2O(g) V
1 3 1 1 2
x mol 2x mol
则有(4-2x) mol/4 mol=0.85 x=0.3
故前2h的平均反应速率v(H2)=0.3 mol×3/2L×2h=0.225 mol·L-1·h-1
②该温度下,反应进行5h时达到平衡状态,此时P后/P前=0.80,设消耗CO2的物质的量为y mol,则有4-2y mol/4 mol=0.80,解得y=0.4,故CO2的平衡转化率为0.4 mol/1 mol×100%=40%
本题答案::0.225 mol·L-1·h-1(或13.5 mol·L-1·min-1) ;40%
(3)设开始时投入CO2和H2的物质的量分别为1 mol、3 mol,CO2的平衡转化率为50%,则有: CO2 ( g) + 3H2 (g)![]() CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g)
起始/ mol 1 3 0 0
转化/ mol 0.5 1.5 0.5 0.5
平衡/ mol 0.5 1.5 0.5 0.5
平衡时p(CO2)=8MPa×0.5 mol/3 mol=4/3 MPa,p(H2)=8MPa×1.5 mol/3 mol=4 MPa,
p(CH3OH)=8MPa×0.5 mol/3 mol=4/3 MPa,p(H2O)=8MPa×0.5 mol/3 mol=4/3 MPa,
故该反应条件下的平衡常数为Kp= p(CH3OH)·p(H2O)/ p(CO2)·p(H2)= 1/48
(4)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热△H<0. ②随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线a代表CO2,C2H4 (g)、H2O (g)都是生成物,随着平衡逆向移动,二者的物质的量逐渐减小,由计量关系可知曲线a代表水,曲线c代表C2H4
本题答案:<;C2H4

【题目】I.中和热测定:
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、________、________。
(2)量取反应物时,取50 mL 0.50 mol·Lˉ1的盐酸,还需加入的试剂是________(填序号)。
a.50 mL 0.50 mol·Lˉ1NaOH溶液
b.50 mL 0.55 mol·Lˉ1NaOH溶液
c.1.0 g NaOH固体
II.现用中和滴定测定某盐酸的浓度,有关数据记录如下:
滴定序号 | 待测液体积(mL) | 所消耗烧碱标准液的体积(mL) | ||
滴定前 | 滴定后 | 消耗的体积 | ||
1 | 25.00 | 0.50 | 25.12 | 24.62 |
2 | 25.00 | / | / | / |
3 | 25.00 | 5.00 | 29.58 | 24.58 |
(3)应用______式滴定管盛装0.2500 mol/L烧碱标准液,锥形瓶中装有25.00mL待测盐酸溶液。
(4)如图表示第二次滴定时50 mL滴定管中前后液面的位置。该次滴定所用标准烧碱溶液体积为_________mL。

(5)根据所给数据,计算出该盐酸的物质的量浓度(注意保留合适的有效数字),c (HCl) = _____________。
(6)读数时,若滴定前仰视,滴定后俯视,则会使最终测定结果_________ (填“无影响”、“偏高”、“偏低”。下同);若装标准液的滴定管在装液前未用标准NaOH溶液润洗,会使最终测定结果_________。
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生氢气体积(V)的数据,根据数据绘制如图,则曲线a、b、c、d所对应的实验组别可能是( )

组别 | c(HCl)/(molL-1) | 温度/℃ | 状态 |
1 | 2.0 | 25 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 粉末状 |
4 | 2.5 | 30 | 粉末状 |
A.④—③—②—①B.①—②—③—④
C.③—④—②—①D.①—②—④—③
【题目】已知以下信息:①1 mol N2的共价键断裂吸收946 kJ的能量;1 mol H2的共价键断裂吸收436 kJ的能量;形成1 mol NH3中的化学键释放1 173 kJ的能量。②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
N2(mol·L-1) | H2(mol·L-1) | NH3(mol·L-1) | |
起始时 | 3 | 3 | 0 |
2s末 | 2.6 | 1.8 | 0.8 |
根据以上相关数据回答问题:
(1)用H2表示该反应2 s内的平均反应速率为________
(2)______(填“能”或“不能”)确认该反应2 s末已达化学平衡状态。
(3)写出该反应的化学方程式:
________________________________________________________________________。
(4)氮气和氢气生成氨气的过程______(填“释放”或“吸收”)能量。
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1

