��Ŀ����
����Ŀ��������18��7�ĸ��ӣ���Ҫ������
A | He | ||||||||||||||||
G | C | D | |||||||||||||||
B | E | F | I | H | |||||||||||||
Fe | Cu | ||||||||||||||||
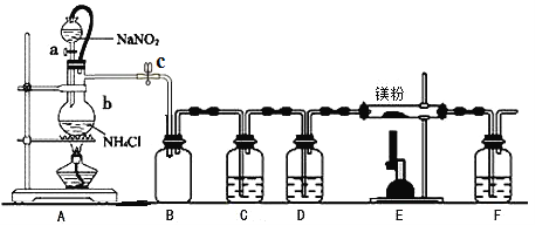
��1���÷�յ�ʵ���Ԫ�����ڱ���������ע�⣺����ʹ��Ǧ����ͼ��
��2��CԪ�ص�һ��������Ϊ10��ͬλ�ص�ԭ�ӷ���Ϊ �� C2�������ӽṹʾ��ͼΪ �� C��D��E��F�ļ����Ӱ뾶��С����˳���� �� ����д���ӷ��� ��
��3��A��G��C�е�2�ֻ�3��Ԫ�����γ�18�����ӵķ��������ѧʽ��������A��GҲ���γ�GA5�����ӻ������������ʽ����
��4����ֱ���1�����ӷ���ʽ˵��B��F�Ľ�����ǿ���� �� C��D�ķǽ�����ǿ�� ��
��5��Feλ�����ڱ������壬������ԭ���ԭ�����ʵ�飬��֤Cu2+��Fe3+�����Ե�ǿ����д���ܷ�Ӧʽ�������缫��Ӧʽ�� �� ���ڷ����ڻ���ʵ��װ��ͼ������ע�缫���Ϻ͵������Һ�� 
���𰸡�
��1��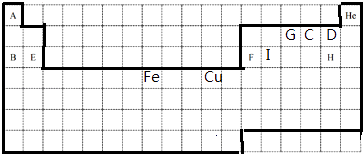
��2��818O��![]() ��Al3+��Mg2+��F����O2��
��Al3+��Mg2+��F����O2��
��3��N2H4��H2O2��![]()
��4��Al3++3OH��=Al��OH��3����Al��OH��3+OH��=AlO2��+2H2O��2F2+2H2O=4HF+O2
��5�������ڣ�VIII�壻2 Fe3++Cu=2Fe2++Cu2+��Cu��2e��=Cu2+��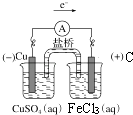
���������⣺����Ԫ�������ڱ��е�λ��֪��A��I�ֱ���H��Na��O��F��Mg��Al��N��Cl��SiԪ��.
��1.��Ԫ�����ڱ�������Ϊ  ��
��
���Դ��ǣ� 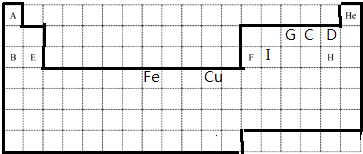 ��
��
��2.��C��OԪ�أ�CԪ�ص�һ��������Ϊ10��ͬλ�أ����Ԫ��ԭ��������Ϊ18����ԭ��Ϊ818O��
C2��������������8�������������10�������ӽṹʾ��ͼΪ ![]() �����Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С�������Ӱ뾶��С����˳����Al3+��Mg2+��F����O2�� �� ���Դ��ǣ�818O��
�����Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С�������Ӱ뾶��С����˳����Al3+��Mg2+��F����O2�� �� ���Դ��ǣ�818O�� ![]() ��Al3+��Mg2+��F����O2����
��Al3+��Mg2+��F����O2����
��3.��A��G��C�е�2�ֻ�3��Ԫ�����γ�18�����ӵķ�����H2O2��N2H4��
����A��GҲ���γ�GA5�����ӻ��������������笠����ӡ�������ΪH�� �� �û��������ʽΪ ![]() �����Դ��ǣ�N2H4��H2O2��
�����Դ��ǣ�N2H4��H2O2�� ![]() ��
��
��4.��Ԫ�صĽ�����Խǿ��������������ˮ�������Խǿ�����ӷ���ʽΪAl3++3OH��=Al��OH��3����Al��OH��3+OH��=AlO2��+2H2O��
Ԫ�صķǽ�����Խǿ���䵥�ʵ�������Խǿ���÷���ʽΪ2F2+2H2O=4HF+O2 ��
���Դ��ǣ�Al3++3OH��=Al��OH��3����Al��OH��3+OH��=AlO2��+2H2O��2F2+2H2O=4HF+O2��
��5.��Feλ�����ڱ��������ڵ�VIII�壬
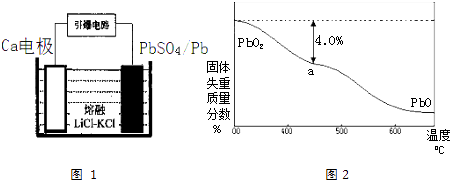
���ԭ���ʵ�飬��֤Cu2+��Fe3+�����Ե�ǿ���������������Դ�ͭ���ӣ���Ӧ����ʽΪ2Fe3++Cu=2Fe2++Cu2+ �� ʧ���ӵĽ���Cu������������Cu���õĽ�����ķǽ�������������ʯī��������ӦʽΪCu��2e��=Cu2+ �� �����Ƶ�ԭ��غ������ţ���缫���������Ӧ�ĵ���ʾ�����ͬԪ�أ���Ƶ�ԭ���Ϊ  ��
��
���Դ��ǣ������ڣ�VIII�壻2 Fe3++Cu=2Fe2++Cu2+��Cu��2e��=Cu2+��  ��
��