题目内容
【题目】铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等,回答下列问题:
(1)铅与碳是同族元素,则下列说法正确的是 .
a.主要化合价为+2,+4
b.同族的Si与Ge(锗)均为半导体材料,铅也为半导体材料.
c.铅的最高价氧化物对应水化物的酸性强于碳酸
d.与同族的Ge(锗)作比较:碱性Ge(OH)4<Pb(OH)4 , 则金属性Ge<Pb,周期表中位置Pb在Ge下面.
e.同族的Ge(锗)与盐酸不反应,Pb与盐酸能反应,则原子半径Ge>Pb
(2)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 .
(3)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g)△H=a kJmol﹣1
PbS(s)+2PbO(s)=3Pb(s)+SO2(g)△H=b kJmol﹣1
PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g)△H=c kJmol﹣1
反应3PbS(s)+6O2(g)=3PbSO4(s)△H=kJmol﹣1(用含a,b,c的代数式表示).
(4)引爆导弹、核武器的工作电源通常Ca/PbSO4热电池,其装置如图1所示,该电池正极的电极反应式为 . 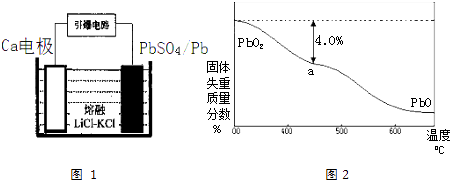
(5)PbO2在加热过程发生分解的失重曲线如图2所示,已知失重曲线上的a点为样品失重4.0%[即:( ![]() ×100%]的残留固体.若a点固体组成表示为PbOx或mPbO2nPbO,列式计算x值 , 和m:n值 .
×100%]的残留固体.若a点固体组成表示为PbOx或mPbO2nPbO,列式计算x值 , 和m:n值 .
【答案】
(1)ad
(2)PbO+ClO﹣=PbO2+Cl﹣
(3)2a+2b﹣3c
(4)PbSO4+2e﹣=SO42﹣+Pb
(5)1.4;2:3
【解析】解:(1.)a.铅与碳是同族元素,最外层电子数为4,主要化合价为+2、+4,故a正确;b.同族的Si与Ge(锗)均为半导体材料,铅是金属不是半导体材料,故b错误;c.同主族最高价氧化物对应水化物形成的酸性减弱,铅的最高价氧化物对应水化物的酸性弱于碳酸,故c错误;d.同主族从上到下金属性增强,形成最高价氢氧化物的碱性增强,与同族的Ge(锗)作比较:碱性Ge(OH)4<Pb(OH)4 , 则金属性Ge<Pb,周期表中位置Pb在Ge下面,故d正确;e.同族的Ge(锗)与盐酸反应,Pb与盐酸能反应,则原子半径Ge<Pb,故e错误;所以答案是:ad;
(2.)PbO和次氯酸钠反应生成二氧化铅和氯化钠,离子方程式为PbO+ClO﹣=PbO2+Cl﹣ , 所以答案是:PbO+ClO﹣=PbO2+Cl﹣;
(3.)已知:①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g)△H=a kJmol﹣1②PbS(s)+2PbO(s)=3Pb(s)+SO2(g)△H=b kJmol﹣1③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g)△H=c kJmol﹣1
将①×2+②×2﹣③×3可得反应3PbS(s)+6O2(g)=3PbSO4(s)
根据盖斯定律△H=2△H1+2△H2﹣3△H3=(2a+2b﹣3c)kJmol﹣1所以答案是:2a+2b﹣3c;
(4.)根据装置图,判断正极为PbSO4发生还原反应,所以答案是PbSO4+2e﹣=SO42﹣+Pb,所以答案是:PbSO4+2e﹣=SO42﹣+Pb;
(5.)若a点固体组成表示为PbOx , 根据PbO2 ![]() PbOx+
PbOx+ ![]() O2↑,
O2↑, ![]() ×32=239×4.0%,x=1.4;若组成为mPbO2nPbO,根据原子守恒得,O原子和Pb原子的比值=x=
×32=239×4.0%,x=1.4;若组成为mPbO2nPbO,根据原子守恒得,O原子和Pb原子的比值=x= ![]() =1.4,得m:n=2:3,所以答案是:1.4;2:3;
=1.4,得m:n=2:3,所以答案是:1.4;2:3;

【题目】下面是18×7的格子,按要求作答
A | He | ||||||||||||||||
G | C | D | |||||||||||||||
B | E | F | I | H | |||||||||||||
Fe | Cu | ||||||||||||||||
(1)用封闭的实线绘出元素周期表的轮廓,注意:不得使用铅笔作图.
(2)C元素的一种中子数为10的同位素的原子符号为 , C2﹣的离子结构示意图为 , C,D,E,F的简单离子半径由小到大顺序是 . (填写离子符号 )
(3)A,G,C中的2种或3种元素能形成18个电子的分子、(填化学式),其中A,G也能形成GA5的离子化合物(填电子式).
(4)请分别用1个离子方程式说明B和F的金属性强弱: , C和D的非金属性强弱 .
(5)Fe位于周期表周期族,请运用原电池原理设计实验,验证Cu2+、Fe3+氧化性的强弱.写出总反应式:负极电极反应式: , 并在方框内画出实验装置图,并标注电极材料和电解质溶液.