题目内容
【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=___________。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H=2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H=______________;
2CO(g)+2H2(g) 的△H=______________;
③在不同温度下催化剂的催化效率与CO的生成速率如右图所示。t1~t2℃时,温度升高而CO的生成速率降低的原因是___________________________________;
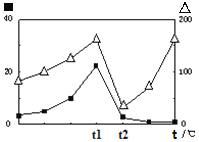 (代表CO的生成速率,■代表催化剂的催化效率)
(代表CO的生成速率,■代表催化剂的催化效率)
④为了提高该反应中CH4的转化率,可以采取的措施是_____________________;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则上述平衡向__________(填“正反应”或“逆反应”)方向移动。
(2)以CO2为原料可以合成多种物质。
①可降解二氧化碳聚合物是由CO2加聚而成,写出其结构简式:_____________;
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为______。
【答案】64 +1379.3 kJ·mol-1 温度超过250℃时,催化剂的催化效率降低 减小压强或增大CO2的浓度 逆反应 ![]() CO2+8e-+6H2O=CH4+8OH-
CO2+8e-+6H2O=CH4+8OH-
【解析】
(1)①根据表中数据,由平衡体系中各组分体积分数可计算各物质的平衡浓度,设平衡时CO2的消耗浓度是x,则甲烷的消耗浓度也是x,CO、H2的平衡浓度则为2x,所以有
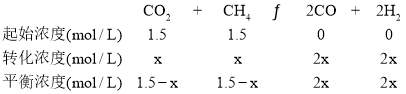
根据题意可得2x/(3+2x)=0.4,解得x=1,所以CO2、CH4、CO、H2的平衡浓度分别是0.5mol/L、0.5mol/L、2mol/L、2mol/L,所以该温度下的平衡常数K=![]() =64;
=64;
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJmol-1ⅰ
CO(g)+H2O(g)=CO2(g)+H2(g)△H=2.8kJmol-1ⅱ
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJmol-1ⅲ
根据盖斯定律,由ⅰ+ⅱ×2-ⅲ×2得,CO2(g)+CH4(g)2CO(g)+2H2(g)△H=-890.3kJmol-1+2.8kJmol-1×2+566.0kJmol-1×2=+247.3 kJmol-1;
③由图可知,t1~t2℃时,温度升高,催化剂的催化效率降低,所以温度升高乙酸的生成速率降低;
④正反应体积增大,则减小反应压强、增大CO2的浓度,平衡正向移动,甲烷的转化率增大;
⑤同时充入2.0mol CO2、6.0mol CH4、4.0mol CO和8.0mol H2,则各物质浓度分别为:c(CO2)=1mol/L,c(CH4)=2mol/L,c(CO)=3mol/L,c(H2)=4mol/L,浓度商为42×32/(1×2)=72>64,所以化学平衡向逆反应方向移动;
(2)①CO2分子内含有碳氧双键,根据加聚反应特点,生成高聚物结构简式为:![]() ;
;
②根据题意,CO2转化为甲烷,C元素化合价降低,发生还原反应,结合电解质溶液得电极反应为:CO2+8e-+6H2O=CH4+8OH-。

 阅读快车系列答案
阅读快车系列答案