题目内容
【题目】某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如下图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积。

假如实验是在标准状况下进行,试回答下列问题:
(1)镁带和稀硫酸应分别置于_________、_________仪器中(填仪器编号);G管可以用化学实验室里的一种常用仪器来改装,你认为这种仪器的名称是__________________。
(2)仪器丙由左、右两根部分组成,它们用橡皮管连通,并装入适量水,上下移动两管可以调节液面高低。甲乙两试管各有两根导管,用橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,接口的连接方式如下:A接连_________,B接连_________,C接连_________ (填写各接口的编号)。
(3)实验中要取用一定质量的镁条样品投入图示试管中,你认为能否用中学化学实验室常用的托盘天平_________,理由是____________。
(4)你认为可用什么方法取镁带样品_________。如果取镁带长l m,质量为 m g,截取镁带长x cm,产生气体体积为V mL,则测得标况下气体摩尔体积应表示为:V(m)= _________Lmol-1。
【答案】甲 乙 50mL碱式滴定管 D E F 不能 量气管的最大量程是50mL,只需0.05g左右镁样品,托盘天平的精度是0.1g,无法用托盘天平称量 用标准卷尺量取镁带 ![]()
【解析】
(1)将盛稀硫酸的乙试管倒置后稀硫酸被压入甲试管后发生反应;G管可以用50 mL碱式滴定管改装;
(2)将盛稀硫酸的乙试管倒置后稀硫酸被压入甲试管,B、E相连起到平衡气压的作用,生成的氢气经C、F通入丙装置中,由G读出氢气的体积;
(3)量气管的最大量程是50 mL,只需0.05 g左右镁带样品;
(4)根据氢气的物质的量、氢气的体积计算气体摩尔体积。
(1)将盛稀硫酸的乙试管倒置后稀硫酸被压入甲试管后发生反应;根据图示,G管可以用50mL碱式滴定管改装;
(2)将盛稀硫酸的乙试管倒置后稀硫酸被压入甲试管,B、E相连起到平衡气压的作用,生成的氢气经C、F通入丙装置中,由G读出氢气的体积,所以A接连D,B接连E,C接连F;
(3)因量气管的最大体积是50mL,经计算可知镁带的质量只能是0.05g左右,而托盘天平的最小量程为0.1g,不能使用托盘天平称量;
(4)已知镁带每米质量为2.5g左右,所以可以用标准卷尺量取镁带;如果镁带长1m,质量为mg,现截取镁带长xcm,则镁的质量是![]() ,物质的量是
,物质的量是![]() ,产生氢气的物质的量为
,产生氢气的物质的量为![]() ,
,![]() ,Vm=
,Vm=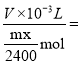
![]() Lmol-1 。
Lmol-1 。

 名校课堂系列答案
名校课堂系列答案【题目】CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=___________。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H=2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) 的△H=______________;
2CO(g)+2H2(g) 的△H=______________;
③在不同温度下催化剂的催化效率与CO的生成速率如右图所示。t1~t2℃时,温度升高而CO的生成速率降低的原因是___________________________________;
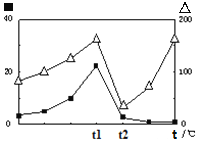 (代表CO的生成速率,■代表催化剂的催化效率)
(代表CO的生成速率,■代表催化剂的催化效率)
④为了提高该反应中CH4的转化率,可以采取的措施是_____________________;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则上述平衡向__________(填“正反应”或“逆反应”)方向移动。
(2)以CO2为原料可以合成多种物质。
①可降解二氧化碳聚合物是由CO2加聚而成,写出其结构简式:_____________;
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为______。