题目内容
著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。)下列说法正确的是
A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI  CeI4 + 2H2↑ CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+ = Ce3+ + 2Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈 |
| D.铈的四种核素13658Ce、13858Ce、14058Ce、14258Ce,它们互称为同素异形体 |
C
解析试题分析:A、根据题给信息知,铈可以和氢碘酸反应生成盐和氢气,但是Ce4+具有氧化性,碘离子具有还原性,二者可以继续发生氧化还原反应,错误;B、氧化性是Ce4+>Fe3+,所以用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+═Ce3++Fe3+,错误;C、电解熔融状态的CeO2,电解池中铈离子在阴极得电子,发生还原反应,即在阴极获得铈,正确;D、同素异形体是同种元素组成的性质不同的单质间的互称,13658Ce、13858Ce、14058Ce、14258Ce属于四种核素,它们互为同位素,错误。
考点:

 通城学典默写能手系列答案
通城学典默写能手系列答案制取下列物质一定有氧化还原反应发生的是
| A.NH3 | B.Mg | C.FeCl3 | D.NaAlO2 |
将69 g NO2(含少量N2O4)通入水中,关于此过程下列说法正确的是(NA表示阿伏加德罗常数)
| A.69 g NO2与N2O4混合气体所含原子数介于4.5 NA至9.0 NA之间 |
| B.此反应中转移的电子数为NA |
| C.最终可收集到11.2 L无色气体 |
| D.若将所得硝酸制成浓硝酸,常温下最多可溶解0.25 mol铁。 |
对剧毒的氰化物可在碱性条件下用如下方法进行处理:2CN-+8OH-+5Cl2=2CO2+N2+10Cl-+4H2O。下列判断正确的是
| A.当有0.2mol CO2生成时,溶液中阴离子的物质的量增加1mol |
| B.该反应中,每有2molCN-反应,转移电子为10mol |
| C.上述反应中的还原剂是OH- |
| D.还原性:C1->CN- |
对于反应14CuSO4+5FeS2+12H2O→7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
| A.只有硫酸铜作氧化剂 |
| B.SO42-既不是氧化产物又不是还原产物 |
| C.被氧化的硫与被还原的硫的质量比为3:7 |
| D.1mol硫酸铜可以氧化5/7mol的硫原子 |
新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni,在该盐中均显+2价)由铁酸盐(MFe2O4)经高温与氢气反应制得,常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图。关于此转化过程的叙述不正确的是
| A.MFe2O4在与H2的反应中表现了氧化性 |
| B.MFe2O4与MFe2Ox的相互转化反应均属于氧化还原反应 |
| C.MFe2Ox与SO2反应中MFe2Ox被还原 |
| D.若4 mol MFe2Ox与1 mol SO2恰好完全反应,则MFe2Ox中x的值为3.5 |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是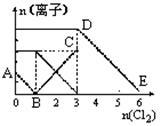
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中n(FeBr2)=3mol |
| C.当通入Cl22mol时,溶液中已发生的离子反应可表示为: 2Fe2++2I-+2C12=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+):n(I-):n(Br-)=3:1: 2 |
下列类型的反应中,一定不属于氧化还原反应的是( )。
| A.化合反应 | B.置换反应 | C.分解反应 | D.复分解反应 |
锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。生成1 mol硝酸锌时,被还原的硝酸的物质的量为( )
| A.2 mol | B.1 mol | C.0.5 mol | D.0.25 mol |