题目内容
对于反应14CuSO4+5FeS2+12H2O→7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
| A.只有硫酸铜作氧化剂 |
| B.SO42-既不是氧化产物又不是还原产物 |
| C.被氧化的硫与被还原的硫的质量比为3:7 |
| D.1mol硫酸铜可以氧化5/7mol的硫原子 |
C
解析试题分析:A.FeS2中S元素化合价为-1价,反应后分别升高为+6价、降低为-2价,所以FeS2中S元素部分被氧化,部分被还原,FeS2既是氧化剂又是还原剂,故A错误;B.SO42-是氧化产物,故B错误;C.由化学方程式可知,反应物中含有14molSO42-离子,生成物中有17molSO42-离子,则有3molS被氧化,7molS被还原,故C正确;D.14mol硫酸铜对应的被氧化的硫原子是3mol,故1mol硫酸铜可以氧化3/14mol的硫原子,故D错误.故选:C。
考点:本题考查氧化还原反应,题目难度中等,解答该题的关键是正确判断各元素的化合价的变化,能从化合价的角度进行判断和计算。

三氟化氮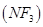 是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:
是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应: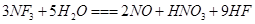 。下列有关该反应的说法正确的是
。下列有关该反应的说法正确的是
A.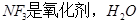 是还原剂 是还原剂 |
B.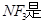 非极性分子,在潮湿空气中泄漏会看到红棕色气体 非极性分子,在潮湿空气中泄漏会看到红棕色气体 |
| C.每消耗0.2mol氧化剂,可收集到5.418L气体 |
D.若生成1mol 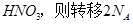 个电子 个电子 |
实验室可以用高锰酸钾与浓盐酸反应制取氯气,反应的化学方程式如下:2KMn04+16HCl(浓) = 2KCl+5Cl2↑+2MnCl2+8H20
对于该反应,下列说法正确的是
| A.HCl是氧化剂 | B.是非氧化还原反应 |
| C.反应中锰元素被还原 | D.反应中氢元素的化合价升高 |
为了测定某铜银合金成分,将30 g合金完全溶于80 mL 13.5 mol/L的浓硝酸中,待反应完全后,收集到0.3 mol气体,并测得溶液中c(H+)是1 mol/L。假设反应后溶液体积仍为80 mL,则合金中银的质量分数为
| A.36% | B.66.3% | C.78.7% | D.96.6% |
著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。)下列说法正确的是
A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI  CeI4 + 2H2↑ CeI4 + 2H2↑ |
| B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+ = Ce3+ + 2Fe3+ |
| C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈 |
| D.铈的四种核素13658Ce、13858Ce、14058Ce、14258Ce,它们互称为同素异形体 |
下列叙述中,正确的是
| A.只含有金属元素的离子不一定是阳离子 |
| B.金属阳离子被还原不一定得到金属单质 |
| C.氧化还原反应中,非金属单质必是氧化剂 |
| D.元素从化合态变为游离态时,一定被还原 |
下列叙述正确的是
①7Li+中含有的中子数与电子数之比为2:1
②在C2H6分子中极性共价键与非极性共价键数之比为3:1
③常温下,11.2 L的甲烷气体中含有的氢、碳原子数之比为4:1
④5.6 g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1
| A.①② | B.②③ | C.①③ | D.③④ |
工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
| A.若管道漏气遇氨就会产生白烟 | B.该反应利用了Cl2的强氧化性 |
| C.该反应NH3被还原 | D.生成1 mol N2有6 mol电子转移 |