题目内容
17.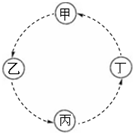 甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化).下列各组物质中,不能满足图示转化关系的是( )
甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化).下列各组物质中,不能满足图示转化关系的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | Fe | FeCl3 | Fe (OH)3 | Fe2O3 |
| B | NaAlO2 | Al (OH)3 | Al2O3 | Al |
| C | Na | Na2O2 | Na2CO3 | NaCl |
| D | SiO2 | H2SiO3 | Na2SiO3 | Si |
| A. | A | B. | B | C. | C | D. | D |
分析 A、Fe$\stackrel{氯气}{→}$FeCl3$\stackrel{氢氧化钠}{→}$Fe (OH)3$\stackrel{△}{→}$Fe2O3;
B、NaAlO2$\stackrel{二氧化碳}{→}$Al (OH)3$\stackrel{△}{→}$Al2O3$\frac{\underline{\;电解\;}}{\;}$Al;
C、Na$\stackrel{氧气}{→}$Na2O2$\stackrel{二氧化碳}{→}$Na2CO3$\stackrel{盐酸}{→}$NaCl;
D、二氧化硅无法一步转化为硅酸.
解答 解:A、Fe$\stackrel{氯气}{→}$FeCl3$\stackrel{氢氧化钠}{→}$Fe (OH)3$\stackrel{△}{→}$Fe2O3,能实现相互转化,故A正确;
B、NaAlO2$\stackrel{二氧化碳}{→}$Al (OH)3$\stackrel{△}{→}$Al2O3$\frac{\underline{\;电解\;}}{\;}$Al,能实现相互转化,故B正确;
C、Na$\stackrel{氧气}{→}$Na2O2$\stackrel{二氧化碳}{→}$Na2CO3$\stackrel{盐酸}{→}$NaCl,能实现相互转化,故C正确;
D、二氧化硅无法一步转化为硅酸,所以不能实现转化,故D错误;
故选D.
点评 本题考查无机物的推断,侧重于元素化合物的综合理解与运用的考查,注意把握物质间的转化,明确物质的性质是解本题关键,采用代入法来分析解答,注意硅和硅酸之间的转化为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列化工生产过程中,需用到电解食盐水产物的是 ( )
| A. | 工业生产纯碱 | B. | 金属铝的冶炼 | C. | 海水中提取溴 | D. | 工业生产玻璃 |
14.反应2SO2+O2?2SO3(g)经一段时间后,SO3的浓度增加了0.2mol/L,在这段时间内用O2表示的反应速率为0.01mol•L-1•s-1,则这段时间为( )
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
2.下列说法不正确的是( )
| A. | 硅是半导体材料,可用于制备光导纤维 | |
| B. | Na2O2能与CO2反应,可用作呼吸面具的供氧剂 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | Al2O3熔点高,可用于制作耐高温仪器 |
9.某盐是一种重要的化工原料,在印染、制革、木材和农业等领域有重要用途,其溶液可能含有NH4+、Al3+、SO42-、Fe2+、Cl-等若干种离子,某同学设计并完成了如下实验:
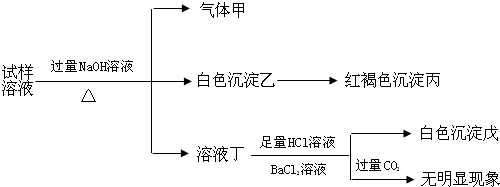
根据以上的实验操作与现象,该同学得出的结论不正确的是( )

根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 试样中肯定有NH4+、SO42-和Fe2+ | |
| B. | 试样中一定没有Al3+ | |
| C. | 若气体甲在标准状况下体积为0.448L,沉淀丙和沉淀戊分别为1.07g和4.66g,则可判断溶液中还有Cl- | |
| D. | 该盐工业上可以用作净水剂 |
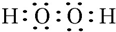 .W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)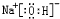 、
、 .
.