题目内容
氧化还原反应规律是化学学科的重要规律之一。按要求回答下列问题:
(1) 被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,此反应中B元素的化合价没有发生变化,则NaBH4中H的化合价为___________,该反应氧化产物是______________,还原产物是______________。
(2) 有下列三个反应:
①Cl2+FeI2=FeCl2+I2 ;②2Fe2++Br2=2Fe3++2Br-;③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
①根据以上方程式可以得到Fe2+、Co2+、Br-、I-还原性由强的弱的顺序为_________;
②1molCo2O3能氧化HCl的物质的量_____________。
(3) 完成并配平下列化学反应方程式:
□KMnO4+□H2C2O4+□________ □CO2+□K2SO4+□MnSO4+□H2O
□CO2+□K2SO4+□MnSO4+□H2O
(4)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2H+ +Zn=Zn2++H2↑,可拆写为氧化反应式:Zn-2e-=Zn 2+,还原反应式:2H++ 2e-=H2↑。并由此实现了化学能与电能的相互转化。据此,回答下列问题:
①将2Fe3++Cu= 2Fe2+ +Cu2+拆写为两个“半反应式”:其中,氧化反应式为 。
②由①中的反应,可设计成如右图所示的原电池:
若电极a为Cu ,电解质溶液甲的化学式为 ;
电极b处的电极反应式为 。
(1)-1,H2、H2(可以写名称,每空均为1分)
(2) ① I->Fe2+>Br->Co2+; ②2mol(没有单位减1分)
(3)2KMnO4+5H2C2O4+3 H2SO4=10CO2+K2SO4+2MnSO4+8H2O(只要错误,不得分)
(4) ①Cu-2e-=Cu2+;②CuSO4,2Fe3++2e-=2Fe2+
解析试题分析:(1)在反应NaBH4+2H2O=NaBO2+4H2↑中B元素的化合价没有发生变化,则根据化学式NaBO2可知,B元素的化合价是+3价,因此在NaBH4中H的化合价为-1价;硼氢化钠中氢元素的化合价从-1价升高到0价,硼氢化钠是还原剂。水中氢元素的化合价才+1价降低0价,水是氧化剂,所以该反应氧化产物和还原产物均是氢气。
(2)①在氧化还原反应中还原剂的还原性强于还原产物的,则根据①Cl2+FeI2=FeCl2+I2可知,碘离子被氧化,氯气被还原,则还原性是I->Cl-;由于氯气首先氧化碘离子,这说明碘离子的还原性强于亚铁离子的。根据②2Fe2++Br2=2Fe3++2Br-可知,亚铁离子被氧化,电子溴被还原,所以还原性是Fe2+>Br-;根据③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O可知,氯离子被氧化,Co2O3被还原,则还原性是Cl->Co2+;又因为氯离子的还原性强于溴离子的,所以Fe2+、Co2+、Br-、I-还原性由强的弱的顺序为I->Fe2+>Br->Co2+。
②Co元素的化合价从+3价降低到+2价,则1molCo2O3能得到2mol电子。氯化氢中氯元素的化合价从-1价升高到0价失去1个电子,则根据电子得失守恒可知,1molCo2O3能氧化HCl的物质的量为2mol。
(3)根据反应式可知,高锰酸钾中Mn元素化合价从+7价降低到+2价,得到5个电子。草酸中碳元素化合价从+3价升高到+4价,失去1个电子,则1分子草酸失去2个电子,因此根据电子得失守恒可知,氧化剂高锰酸钾与还原剂草酸的物质的量之比=2:5,根据原子守恒可知,反应物还有硫酸参加,因此依据原子守恒和电子得失守恒可知,配平后的化学方程式为2KMnO4+5H2C2O4+3H2SO4=10CO2↑+K2SO4+2MnSO4+8H2O。
(4)①根据已知信息可知,氧化反应式就是失去电子发生氧化反应,在原电池中属于负极电极反应式。则根据反应2Fe3++Cu= 2Fe2+ +Cu2+可知,氧化剂是铁离子,还原剂是铜,因此铜是负极。所以如果拆写为两个“半反应式”:其中,氧化反应式为Cu-2e-=Cu2+;
②若电极a为Cu,则a是负极,铜失去电子生成铜离子,则电解质溶液甲的化学式为CuSO4;b电极是正极,溶液中的铁离子得到电子被还原为亚铁离子,则电极b处的电极反应式为2Fe3++2e-=2Fe2+。
考点:考查氧化还原反应的判断、应用、配平和计算;原电池原理的应用、判断和电极反应式的书写

“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭一面涂上一种特殊的涂料,该涂料的性质最可能的是 。
| A.在高温下不融化 | B.在高温下可分解气化 |
| C.在常温下就分解气化 | D.该涂料不可能发生分解 |
该反应中被氧化的原子与被还原的原子的物质的量之比是 。这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是 。
(3)如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,燃料电池放电时的负极反应为: 。如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为 mol。

(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。 已知该反应的阳极反应为:4OH—4e-=O2↑+2H2O 则阴极反应为: 。有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断上述反应是否能发生? 理由 。
(5).北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。丙烷脱氢可得丙烯。
已知:①C3H8(g)
 CH4(g)+HC≡CH(g)+H2(g); △H1="156.6" kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g); △H1="156.6" kJ·mol-1②CH3CH=CH2(g)
 CH4(g)+ HC≡CH (g);△H2="32.4" kJ·mol-1
CH4(g)+ HC≡CH (g);△H2="32.4" kJ·mol-1则相同条件下,反应C3H8(g)
 CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1 氧化还原反应在生产、生活中具有广泛用途,贯穿古今。
(1)下列生产、生活中的事例中有发生氧化还原反应的是 。(有两个正确选项)
| A.古代活字印刷 | B.原电池工作 | C.简单机械织布 | D.我国古代湿法炼铜 |
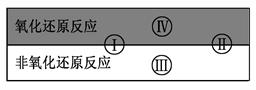
试写出有水参加的符合反应类型Ⅳ的一个化学方程式: 其中水为 剂。
(3)氯化铵常用于焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为: CuO+ NH4Cl = Cu+ CuCl2+ N2+ H2O
①配平此氧化还原反应方程式
②该反应中,被氧化的元素是 (填元素名称),氧化剂是 (填化学式)
③反应中若产生0.2mol的气体,则有 个电子转移。
碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛。
完成下列填空:
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。请完成并配平上述反应:
____KI+____CuSO4 → ____I2+____Cu2I2↓+ ____________
该反应中氧化剂与还原剂的物质的量之比为___________。
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。
写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是____________________。
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:
2Cu2I2+Hg → Cu2HgI4(玫瑰红)+ 2Cu
产物Cu2HgI4中,Cu元素显____价。
当有1 molCu2I2参与反应时,转移电子____mol。
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再通入适量的Cl2后进行N操作。试剂M和操作N的组合正确的是_____(选填编号)
| 选项 | 试剂M | 操作N |
| a | 碘化钾溶液 | 升华 |
| b | 氢碘酸溶液 | 萃取分液 |
| c | 氢气 | 过滤 |
| d | 氢硫酸溶液 | 过滤 |
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(2)目前已开发出用电解法制取ClO2的新工艺。
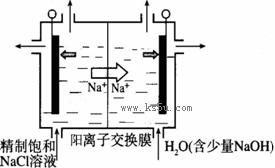
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式: 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因 。
ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为 ,处理100 m3这种污水,至少需要ClO2 _______mol。
(14分)2013年6月,我国“蛟龙”号再次刷新“中国深度”——下潜7062米,为我国深海矿物资源的开发奠定了基础。海洋深处有丰富的锰结核矿,锰结核的主要成分是MnO2,同时还含有黄铜矿。
Ⅰ、“蛟龙”号外壳是用特殊的钛合金材料制成,它可以在7000m的深海中承受重压,Ti是以钛白粉(TiO2)为原料进行生产,钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解的离子方程式为____________________________。
Ⅱ、MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如下图所示: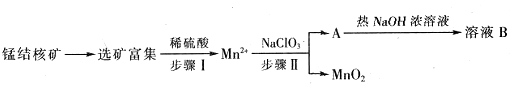
(1)步骤Ⅱ中以NaClO3为氧化剂,当生成0.05molMnO2时,消耗0.1mol/L的NaClO3溶液200ml,该反应离子方程式为_______________________________。
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是____________。
Ⅲ、利用黄铜矿炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)可制备Fe2O3,方法为:
(A)用过量的稀盐酸浸取炉渣、过滤;(B)向滤液中加入5%的H2O2,再向其中加入过量的NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得到Fe2O3。根据以上信息回答下列问题:
(1)(B)中向滤液中加入5%的H2O2,其目的是_________________________________。
(2)设计实验证明炉渣中含有FeO___________________________________________。
(3)将煅烧得到的Fe2O3还原为Fe单质,再将质量为m g的Fe单质分成相等的四份,分别与50mL、100mL、150mL、200mL的等浓度的稀硝酸反应,反应产物NO在标况下的体积见附表:
| 实验 | ① | ② | ③ | ④ |
| V(HNO3)/ml | 50 | 100 | 150 | 200 |
| V(NO)/L | 1.344 | 2.688 | 3.36 | 3.36 |
②写出实验②发生反应的化学方程式:_____________________________。