题目内容
CuSO4溶液与K2C2O4溶液混合生成一种蓝色钾盐水合物KaCub(C2O4)c·nH2O。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.2000mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL KMnO4溶液。有关反应:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步骤b:接着将溶液充分加热。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL Na2S2O3溶液。滴定时反应为:I2+2S2O32-=2I-+S4O62-
(1)步骤b中生成白色沉淀的离子方程式: 。
(2)步骤b中“将溶液充分加热”的目的是 。
(3)请完成下列确定样品组成的计算过程。
①计算样品中n (C2O42-)(写出计算过程)
②计算样品中n (Cu2+) (写出计算过程)
③根据 原理可求出n (K+),再依据 原理求得n (H2O)
④该样品晶体的化学式为
(1)2Cu2++4I-=2CuI↓+I2 (2)除去微量的MnO4-,以免影响实验结果的测定
(3)① 2MnO4- ~ 5C2O42- ② 2S2O32- ~ I2 ~ 2Cu2+
2 5 2 2
0.2×8×10-3mol 4×10-3mol 0.25×8×10-3mol 2×10-3mol
n (C2O42-)= 4×10-3mol n (Cu2+)= 2×10-3mol
③电荷守恒 质量守恒 ④K2Cu(C2O4)2·H2O
解析试题分析:(1)由Cu2+→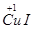 ~e-,2I-→I2~2e-,结合原子守恒和电荷守恒配平。
~e-,2I-→I2~2e-,结合原子守恒和电荷守恒配平。
(2)MnO4-与C2O42-发生氧化还原反应,加热可使二者反应充分,防止MnO4-对后面的实验干扰。
(3)①由关系式2MnO4- ~ 5C2O42-,n (C2O42-)=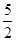 n (MnO4-)= 0.2×8×10-3mol= 4×10-3mol;
n (MnO4-)= 0.2×8×10-3mol= 4×10-3mol;
②由关系式2S2O32- ~ I2 ~ 2Cu2+,n (Cu2+)= n (S2O32-)= 0.25×8×10-3mol = 2×10-3mol
③电荷守恒式:n(K+)+2n(Cu2+)=2n( C2O42-),将n (Cu2+)= 2×10-3mol,n (C2O42-)= 4×10-3mol带入,解得n(K+)=4×10-3mol;m(H2O)=m(样品)-m (K+)- m(Cu2+)-m( C2O42-)。
④m(H2O)="0." 6720g-4×10-3mol×39g?mol-1-2×10-3mol×64g?mol-1-4×10-3mol×88 g?mol-1=0.036g
n(H2O)="0.036" g/(18 g?mol-1)="0." 002 mol,即n(K+): n(Cu2+): n( C2O42-):n(H2O)=2:1:2:1,即化学式为K2Cu(C2O4)2·H2O。
考点:考查晶体的组成测定,涉及到氧化还原反应的知识,掌握实验的原理是解题的关键,难度中等。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案已知氧化还原反应与四种基本反应类型的关系可用如图表示,下列是有水参加或生成的几种反应:
①CaO+H2O =Ca(OH)2
②2Na+H2O=2NaOH+H2↑
③H2+CuO  Cu +H2O
Cu +H2O
④3S+6NaOH  2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O
⑤NaOH+HCl=NaCl+H2O
请回答下列问题:
(1)反应①中水 (填字母)。
| A.是氧化剂 |
| B.是还原剂 |
| C.既是氧化剂又是还原剂 |
| D.既不是氧化剂又不是还原剂 |
(3)上述反应中,属于区域Ⅲ的是 (填序号)。
(4)写出一种符合区域Ⅴ且既有沉淀生成又有水生成的离子方程式: 。
水是组成生命体的重要物质,有关水的反应实例有很多。
(1)有人设想将太阳能转化为电能,进而将水电解生成氢气,氢气是一种清洁能源。请分析电解水的过程中,水是_____________(填仅被氧化,仅被还原,既被氧化又被还原,既不被氧化又不被还原)
(2)野营爱好者携带氢化钙固体作为生氢剂,方程式为CaH2+2H2O=Ca(OH)2+2H2↑,其中水是_____________(填仅被氧化,仅被还原,既被氧化又被还原,既不被氧化又不被还原)
(3)在下列反应中水只被还原的是_____________(填序号)
| A.C+H2O=CO+H2 | B.CaO+H2O=Ca(OH)2 |
| C.3Fe+4H2O=Fe3O4+4H2 | D.3NO2+H2O=2HNO3+NO |
3NO2+H2O=2HNO3+NO
 □CO2+□K2SO4+□MnSO4+□H2O
□CO2+□K2SO4+□MnSO4+□H2O
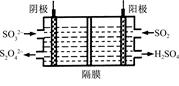
 2NaHSO4+MnSO4+2H2O+I2
2NaHSO4+MnSO4+2H2O+I2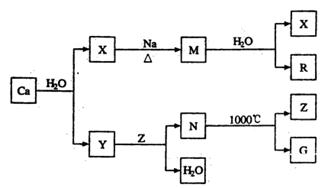
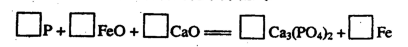
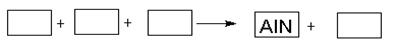
 AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
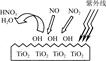
AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。 HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。
HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。