��Ŀ����
�����ߡ������־���ҹ��ĺ�����ҵ�������µ�ƪ�¡�
��1���������ʱ�������������ľ���Ħ�����������¡�Ϊ�˷�ֹ����¶ȹ��ߣ��ڻ��һ��Ϳ��һ�������Ϳ�ϣ���Ϳ�ϵ���������ܵ��� ��
| A���ڸ����²��ڻ� | B���ڸ����¿ɷֽ����� |
| C���ڳ����¾ͷֽ����� | D����Ϳ�ϲ����ܷ����ֽ� |
�÷�Ӧ�б�������ԭ���뱻��ԭ��ԭ�ӵ����ʵ���֮���� �������ӦӦ���ڻ���ƽ��������ͷŴ������ȺͿ��ٲ������������⣬����һ���ܴ���ŵ��� ��
��3����ͼ��ij�ռ�վ����ת��ϵͳ�ľֲ�ʾ��ͼ������ȼ�ϵ�ز���KOHΪ���Һ��ȼ�ϵ�طŵ�ʱ�ĸ�����ӦΪ�� �����ij��ʱ�������������й��ռ���33.6L���壨������ɱ��������ö�ʱ����ˮ���ϵͳ��ת�Ƶ��ӵ����ʵ���Ϊ mol��

��4�������˺���������̬ϵͳ�У�����Ҫ�����ȥ��CO2����Ҫ���ṩ�����O2��ij�ֵ绯ѧװ�ÿ�ʵ������ת����2CO2=2CO+O2��CO������ȼ�ϡ� ��֪�÷�Ӧ��������ӦΪ��4OH��4e-=O2��+2H2O ��������ӦΪ�� �����������������Ʒ�Ӧ2CO=2C+O2����H��0����S��0��������CO����Ⱦ�������ж�������Ӧ�Ƿ��ܷ����� ���� ��
��5��.�������˻ᡰ���ơ����ȼ���DZ��飨C3H8��������������˻���ȼ���DZ�ϩ(C3H6)����������ɵñ�ϩ��
��֪����C3H8(g)
 CH4(g)+HC��CH(g)+H2(g)�� ��H1="156.6" kJ��mol-1
CH4(g)+HC��CH(g)+H2(g)�� ��H1="156.6" kJ��mol-1��CH3CH=CH2(g)
 CH4(g)+ HC��CH (g)����H2="32.4" kJ��mol-1
CH4(g)+ HC��CH (g)����H2="32.4" kJ��mol-1����ͬ�����£���ӦC3H8(g)
 CH3CH=CH2(g)+H2(g)�ġ�H=_____kJ��mol-1
CH3CH=CH2(g)+H2(g)�ġ�H=_____kJ��mol-1
��1��B ��2��1 2 3 4 ��2��1 ��������Ⱦ��3��H2-2e-+2OH-=2H2O 2
��4��2CO2+4e-+2H2O=2CO+4OH- ������ ��H>0������ ��S<0 ��5��(124.2)
���������������Ϳ�ϵ���������ܵ����ڸ����¿ɷֽ��������ֽ����ȣ���������Ҳ���Ĵ���������������ʹ����¶Ƚ��͡�ѡ��Ϊ��B����2�����������Ҫ�������ܵķ�Ӧ�ķ���ʽ��1N2O4+2N2H4==3N2+4H2O��ϵ����1 2 3 4���÷�Ӧ�б�����N2H4�е�N��ԭ���뱻��ԭ��ԭ�ӵ�N2O4�е�Nԭ�ӵ����ʵ���֮����2:1. �����ӦӦ���ڻ���ƽ��������ͷŴ������ȺͿ��ٲ������������⣬����һ���ܴ���ŵ��Dz�������Ⱦ���ྻ����������3��������ȼ�ϵ���У�ͨ��H2�ĵ缫�������������ĵ缫��ӦΪ��H2-2e-+2OH-=2H2O. 2H2O------2H2��+ O2������������3mol,ת�Ƶ���4mol.���ڲ������干1.5mol������ת�Ƶ���2mol.��4�������ܷ�Ӧʽ�������ĵ缫��Ӧʽ�ɵõ�������ӦΪ:2CO2+4e-+2H2O=2CO+4OH- �������2CO=2C+O2����H��0����S��0��������CO����Ⱦ�ķ��������С�ԭ���Ǹ÷�Ӧ�ġ�H>0�������ȷ�Ӧ����S<0����ϵ�Ļ��ҳ̶ȼ�С����5����-�������ã�C3H8(g)  CH3CH=CH2(g)+H2(g)�ġ�H=124.2KJ/mol.
CH3CH=CH2(g)+H2(g)�ġ�H=124.2KJ/mol.
���㣺���麽����ҵ�漰���ĸ������⼰��ѧ��Ӧ�����������ȵ�֪ʶ��

 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д���������(H2O2)��һ����ɫ��Һ��,����ˮ��Һ�׳�˫��ˮ,��������,����������������ɱ������Ư���ȡ�
(1)����˵����ȷ���� ��
| A��������������м��м��Լ����зǼ��Լ� |
| B��H2O2��H2O��Ϊͬ�������� |
| C��34 g H2O2�к��е���������ΪNA |
| D��ʵ���ҿ������ù���������ȡ���� |
(3)��H2O2��Һ��������FeCl2��Һ��,��Һ��dz��ɫ��Ϊ�ػ�ɫ,д���÷�Ӧ�����ӷ���ʽ: ��
(4)ij����ҵ��ˮ�к���һ��������,Ϊ�˳�ȥ����,������H2O2�����ȼ�,д���÷�Ӧ�Ļ�ѧ����ʽ: ��
��֪������ԭ��Ӧ�����ֻ�����Ӧ���͵Ĺ�ϵ������ͼ��ʾ����������ˮ�μӻ����ɵļ��ַ�Ӧ��
��CaO+H2O =Ca(OH)2
��2Na+H2O=2NaOH+H2��
��H2+CuO  Cu +H2O
Cu +H2O
��3S+6NaOH  2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O
��NaOH+HCl=NaCl+H2O
��ش��������⣺
��1����Ӧ����ˮ ������ĸ����
| A���������� |
| B���ǻ�ԭ�� |
| C���������������ǻ�ԭ�� |
| D���Ȳ����������ֲ��ǻ�ԭ�� |
��3��������Ӧ�У������������� ������ţ���
��4��д��һ�ַ���������Ҽ��г�����������ˮ���ɵ����ӷ���ʽ�� ��
ŷ��ԭ����2012��1��1�������պ���̼��˰��Ӧ�Ա����ڻ���ȫ���ů��ʹ�ö���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������̼��Դ���о��Եø��ӽ��ȡ������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
��1�����������ҹ���������̼���о�ȡ���ش��չ���õ绡���ϳɵ�̼�����г����д���̼�����������ʣ�������̼���������������������ᴿ���䷴Ӧ�Ļ�ѧ����ʽΪ��
__C+__K2Cr2O7+__ ��__CO2��+ __K2SO4 + __Cr2(SO4)3+__H2O
����ɲ���ƽ������ѧ����ʽ��
��2���״���һ������ȼ�ϣ��״�ȼ�ϵ�ؼ�����ʵ��������ҵ����������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO��g��+ 2H2��g�� CH3OH��g�� ��H1����116 kJ��mol-1
CH3OH��g�� ��H1����116 kJ��mol-1
�����д�ʩ������������÷�Ӧ�ķ�Ӧ���ʵ��� _______��
| A����ʱ��CH3OH�뷴Ӧ�������� | B�����ͷ�Ӧ�¶� |
| C��������ϵѹǿ | D��ʹ�ø�Ч���� |
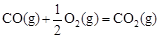 ��H2����283 kJ��mol-1
��H2����283 kJ��mol-1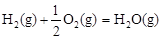 ��H3����242 kJ��mol-1
��H3����242 kJ��mol-1���ʾ1mol��̬�״���ȫȼ������CO 2��ˮ����ʱ���Ȼ�ѧ����ʽΪ ��
�����ݻ�Ϊ1L�ĺ��������У��ֱ��о���230�桢250���270�������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ1mol����COƽ��ת���ʵĹ�ϵ����ش�:
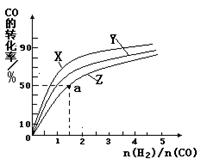
���������������¶��У�����Z��Ӧ���¶���
��������ͼ��a���Ӧ�����ݣ����������Z�ڶ�Ӧ�¶���CO��g��+ 2H2��g��
 CH3OH��g����ƽ�ⳣ��K = ��
CH3OH��g����ƽ�ⳣ��K = ��  CO(NH2)2 (l) + H2O (l)��
CO(NH2)2 (l) + H2O (l)��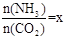 ����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ����___________��
����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ����___________��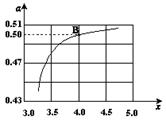
 HSO3 -+H+ K=1.5��10-2
HSO3 -+H+ K=1.5��10-2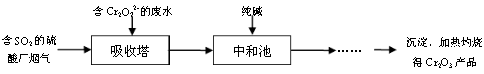
 ��I
��I ��CO2+��K2SO4+��MnSO4+��H2O
��CO2+��K2SO4+��MnSO4+��H2O