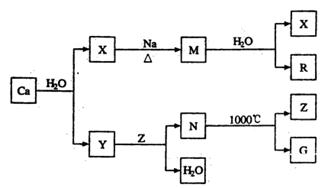
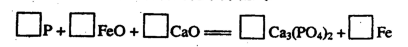题目内容
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(2)目前已开发出用电解法制取ClO2的新工艺。
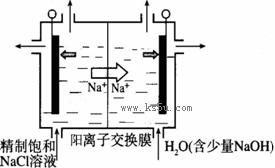
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式: 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因 。
ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为 ,处理100 m3这种污水,至少需要ClO2 _______mol。
(1)①B ② 0.1
(2)①Cl- - 5e-+2H2O=ClO2↑+4H+
②0.01 在阴极发生2H++2e-=H2↑,H+浓度减小,使得H2O OH-+H+的平衡向右移动,OH-浓度增大,pH增大
OH-+H+的平衡向右移动,OH-浓度增大,pH增大
(3)2ClO2+2CN-=N2↑+2CO2↑+2Cl- 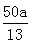 (或3.85a)
(或3.85a)
解析试题分析:(1)浓盐酸在反应中的产物是Cl2和NaCl,一部分化合价升高,一部分没变生成盐,故选B;在反应2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl中每生成1molClO2转移1mol电子,故若反应中产生0.1molClO2,则转移电子的物质的量为0.1mol;(2)阳极发生氧化反应,即Cl-放电生成ClO2。阴极H+放电生成H2,每生成112 mL H2,即有0.01molH+放电,那么通过阳离子交换膜的阳离子的物质的量为0.01mol(3)100 m3污水中含有CN-的物质的量为:100 m3*1000L/ m3*a mg/L*10-3g/mg/26g/mol=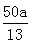
考点:本题综合考查氧化还原和电化学、化学平衡理论。

练习册系列答案
相关题目
(1)某化学课外小组用海带为原料制取少量碘水,现在用四氯化碳在碘水中萃取碘单质,并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
| A.把盛有溶液的分液漏斗敖在铁架台的铁圈中: |
| B.把50mL碘水和15mL四氯化碳加入分液漏斗中,并盖好玻璃塞: |
| C.检验分液漏斗活塞和上口玻璃塞是否漏液; |
| D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞: |
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽(或小孔)对准漏斗口上的小孔:
H.静置、分层。就此实验,完成下列填空:
正确操作步骤的顺序是: 。
(2)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发如下反应:Mn2++S2O82?+H2O—MnO4?+SO42?+H+
该反应常用于检验Mn2+的存在。其特征现象是 。
若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2SO4— Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目:
②上述反应中还原产物是
(10分)为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。
| 实验操作 | 实验现象 |
| ⅰ.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| ⅲ.打开B中分流漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是___________。
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是____________。
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(3)ⅲ中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br― 观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是___________________________________。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是________。
 、I
、I □CO2+□K2SO4+□MnSO4+□H2O
□CO2+□K2SO4+□MnSO4+□H2O