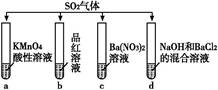
题目内容
现有如下仪器,仪器中已注入溶液,回答下列问题。
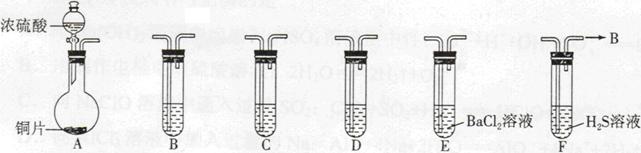
(1)加热装置A,写出铜与浓硫酸反应的化学方程式: ,烧瓶中的实验现象为 。
(2)验证碳、硅非金属性的相对强弱(已知酸性:H2SO3>H2CO3),若选择仪器A、B、C、D并相连接,则B、C、D中所选择的试剂分别为 、 、 。能说明碳的非金属性比硅强的实验现象是 。
(3)验证SO2的氧化性、还原性。若选择A、E、F仪器,并按A、E、F顺序连接。
①则证明SO2有氧化性的实验现象是 ,反应方程式为:
。
②若证明SO2具有还原性,在E中采取的实验操作为 ,其实验现象为 ,反应原理为 。

(1)加热装置A,写出铜与浓硫酸反应的化学方程式: ,烧瓶中的实验现象为 。
(2)验证碳、硅非金属性的相对强弱(已知酸性:H2SO3>H2CO3),若选择仪器A、B、C、D并相连接,则B、C、D中所选择的试剂分别为 、 、 。能说明碳的非金属性比硅强的实验现象是 。
(3)验证SO2的氧化性、还原性。若选择A、E、F仪器,并按A、E、F顺序连接。
①则证明SO2有氧化性的实验现象是 ,反应方程式为:
。
②若证明SO2具有还原性,在E中采取的实验操作为 ,其实验现象为 ,反应原理为 。
(1)Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O; 1分
CuSO4+SO2↑+2H2O; 1分
铜片变灰黑色表面有气泡生成,烧瓶中可能有白色物质生成 2分
(2)B:Na2CO3溶液或 NaHCO3 溶液 C:KMnO4溶液 D:Na2SiO3溶液 ;
C中KMnO4溶液不褪色(或品红不褪色),D中出现白色沉淀。 各1分,共4分
(3)①H2S溶液中有浅黄色混浊出现 2H2S+SO2=3S↓+2H2O 各1分共2分
②通入氯气或加入氯水或加入过氧化氢溶液,或高锰酸钾溶液等氧化剂(其中一种或其它合理答案均可);现象是有白色沉定生成。 各1分共2分
根据所加入试剂写出方程式 Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl? 2分
 CuSO4+SO2↑+2H2O; 1分
CuSO4+SO2↑+2H2O; 1分铜片变灰黑色表面有气泡生成,烧瓶中可能有白色物质生成 2分
(2)B:Na2CO3溶液或 NaHCO3 溶液 C:KMnO4溶液 D:Na2SiO3溶液 ;
C中KMnO4溶液不褪色(或品红不褪色),D中出现白色沉淀。 各1分,共4分
(3)①H2S溶液中有浅黄色混浊出现 2H2S+SO2=3S↓+2H2O 各1分共2分
②通入氯气或加入氯水或加入过氧化氢溶液,或高锰酸钾溶液等氧化剂(其中一种或其它合理答案均可);现象是有白色沉定生成。 各1分共2分
根据所加入试剂写出方程式 Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl? 2分
|
 CuSO4+SO2↑+2H2O;烧瓶中的实验现象为铜片变灰黑色表面有气泡生成,烧瓶中可能有白色物质生成
CuSO4+SO2↑+2H2O;烧瓶中的实验现象为铜片变灰黑色表面有气泡生成,烧瓶中可能有白色物质生成(2)因为酸性:H2SO3>H2CO3> H2SiO3,若选择仪器A、B、C、D,A中产生二氧化硫气体,需和碳酸盐反应产生二氧化碳气体,在通入硅酸钠溶液之前应把二氧化硫除去以免给实验带来干扰。所以B、C、D依次放Na2CO3溶液或 NaHCO3 溶液、KMnO4溶液(或品红溶液)、Na2SiO3溶液,能说明碳的非金属性比硅强的实验现象是C中KMnO4溶液不褪色(或品红不褪色),D中出现白色沉淀。
(3) ①则证明SO2有氧化性的实验是将二氧化硫气体通入硫化氢溶液中,有淡黄色浑浊产生,对应的化学方程式为2H2S+SO2=3S↓+2H2O,在该反应中二氧化硫作氧化剂,显示氧化性,
②若将二氧化硫直接通入氯化钡溶液中无现象,需将二氧化硫进一步氧化,氧化剂可选氯气、氯水、过氧化氢溶液、高锰酸钾溶液、铁盐溶液等,对应的现象是有白色沉淀产生,反应原理是:根据所加入试剂写出离子方程式 Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl?

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题: a% c.
a% c. (1-a%) D.无法计算
(1-a%) D.无法计算