题目内容
【题目】在一定体积的容器中加入1.5mol氙气和7.5mol氟气,于400℃和2633Kpa压强下加热数小时,然后迅速冷至25℃,容器内除得到一种无色晶体外,还余下4.5mol氟气。则所得无色晶体产物中,氙和氟的原子个数之比是 ( )
A.1 :6B.1 :4C.1 :3D.1 :2
【答案】B
【解析】
参加反应的氙气和氟气的物质的量之比为1.5:(7.5-4.5)=1:2,氙气是单原子分子,氟气是双原子分子,所以得到的无色晶体中,氙和氟的原子个数比为1:4。故选B。

【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含有少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取。

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表所示。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)“熔融”时ZrSiO4发生反应的化学方程式为________________________________。
(2)“滤渣Ⅰ”的化学式为________________。
(3)为使滤液Ⅰ中的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是________;继续加氨水至pH=b时,所发生反应的离子方程式为__________________________________________。
(4)向“过滤Ⅲ”所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为____________________________。
【题目】下表是元素周期表中的一部分,根据①~⑨在周期表中的位置,用元素符号或化学式回答下列问题:
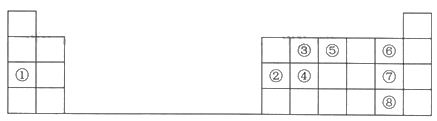
(1)元素④在元素周期表中的位置为________。
(2)最高价氧化物的水化物中碱性最强的物质的电子式为________。
(3)写出②和⑦两种元素的最高价氧化物的水化物相互反应的化学方程式:_______。
(4)④、⑤、⑥三种元素按原子半径由大到小的顺序排列为_______。
(5)③和⑦两种元素形成的简单化合物的结构式为_______,空间构型为________。
(6)设计实验探究⑦、⑧两种元素非金属性的相对强弱。
可选用的试剂有:氯水、NaBr溶液、AgNO3溶液、苯。
请完成实验报告单。
步骤一 | 步骤二 | |
实验内容 | 试管1:取少量氯水; 试管2:取少量氯水,滴加少量NaBr溶液。 | 分别向试管1、试管2中加少量______(填试剂),振荡,静置。 |
实验现象 | 试管2中的现象是______。 | 试管2中的现象是_______。 |
实验分析 | 试管1的作用是_____。 | 试管2中反应的离子方程式为_____,此实验的结论是_____。 |
