题目内容
【题目】已知:⑴Zn(s)+ ![]() O2(g)=ZnO(s),△H=﹣350kJmol﹣1 , ⑵2Ag(s)+
O2(g)=ZnO(s),△H=﹣350kJmol﹣1 , ⑵2Ag(s)+ ![]() O2(g)=Ag2O(s),△H=﹣25kJmol﹣1 ,
O2(g)=Ag2O(s),△H=﹣25kJmol﹣1 ,
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于( )
A.﹣375 kJmol﹣1
B.﹣325 kJmol﹣1
C.+375 kJmol﹣1
D.+325 kJmol﹣1
【答案】B
【解析】解:⑴Zn(s)+ ![]() O2(g)=ZnO(s),△H=﹣350kJmol﹣1,
O2(g)=ZnO(s),△H=﹣350kJmol﹣1,
⑵2Ag(s)+ ![]() O2(g)=Ag2O(s),△H=﹣25kJmol﹣1,
O2(g)=Ag2O(s),△H=﹣25kJmol﹣1,
依据盖斯定律(1)﹣(2)得到
Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)△H=﹣325 kJmol﹣1;
故选B.

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案【题目】下表是元素周期表中的一部分,根据①~⑨在周期表中的位置,用元素符号或化学式回答下列问题:
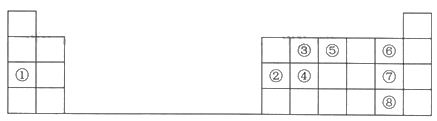
(1)元素④在元素周期表中的位置为________。
(2)最高价氧化物的水化物中碱性最强的物质的电子式为________。
(3)写出②和⑦两种元素的最高价氧化物的水化物相互反应的化学方程式:_______。
(4)④、⑤、⑥三种元素按原子半径由大到小的顺序排列为_______。
(5)③和⑦两种元素形成的简单化合物的结构式为_______,空间构型为________。
(6)设计实验探究⑦、⑧两种元素非金属性的相对强弱。
可选用的试剂有:氯水、NaBr溶液、AgNO3溶液、苯。
请完成实验报告单。
步骤一 | 步骤二 | |
实验内容 | 试管1:取少量氯水; 试管2:取少量氯水,滴加少量NaBr溶液。 | 分别向试管1、试管2中加少量______(填试剂),振荡,静置。 |
实验现象 | 试管2中的现象是______。 | 试管2中的现象是_______。 |
实验分析 | 试管1的作用是_____。 | 试管2中反应的离子方程式为_____,此实验的结论是_____。 |
【题目】现有5瓶失去标签的液体,已知它们可能是乙醇、乙酸、苯、乙酸乙酯、葡萄糖中的一种。现通过如下实验来确定各试剂瓶中所装液体的名称:
实验步骤和方法 | 实验现象 |
①把5瓶液体分别依次标号A、B、C、D、E,然后闻气味 | 只有E没有气味 |
②各取少量于试管中 ,加水稀释 | 只有C、D不溶解而浮在水面上 |
③分别取少量5种液体于试管中,加新制Cu(OH)2并加热 | 只有B使沉淀溶解,E中产生砖红色沉淀 |
④各取C、D少量于试管中,加稀NaOH溶液并加热 | 只有C仍有分层现象,且在D的试管中闻到特殊香味 |
(1)写出这6种物质的名称。
A____________ B____________ C____________ D____________ E____________
(2)在D中加入NaOH溶液并加热的化学方程式为__________________
