题目内容
【题目】用如图所示装置(夹持仪器省略)进行实验,将液体A逐渐加入固体B中。回答下列问题:
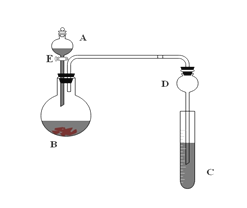
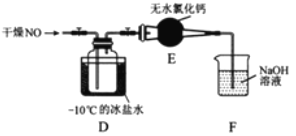
(1)图中D装置在实验中的作用____________________;
(2)若A中为浓盐酸,B中为高锰酸钾,C中盛有KI淀粉溶液,旋开E后,C中的现象是溶液变蓝色,试写出A与B反应的化学方程式_________________________:
(3)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E足够长的时间后,C中的现象是____________________,C中发生反应的化学方程式为:__________;
【答案】防止倒吸 2KMnO4+16HCl=2KCl+2MnCl2+Cl2↑+8H2O 产生白色沉淀 AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
【解析】
(1)装置D是长颈漏斗,作用是防止倒吸;
(2)C中现象溶液变蓝色,说明C中产生I2,烧瓶中产生气体,把I-氧化成I2,即烧瓶中产生Cl2,利用酸性高锰酸钾的氧化性把Cl-氧化成Cl2,即离子方程式为 2KMnO4+16HCl=2KCl+2MnCl2+Cl2↑+8H2O;
(3)生石灰与水放出大量的热,NH3·H2O受热分解成NH3,即烧瓶中产生气体为NH3,NH3与AlCl3溶液发生:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl,C中现象为产生白色沉淀。

【题目】中科院官微曾给出灰霾中细颗粒物的成因,部分分析如下图所示。

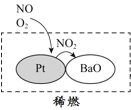
(1)根据如图信息可以看出,所列的气体污染物并非由机动车行驶造成的是______。汽车发动机废气稀燃控制系统主要工作原理如上右图所示;写出稀燃过程中NO发生的主要反应的方程式_____________________________________。
(2)农业活动排出的氨可能是施用的化肥分解,也可能是施用不当导致的。比如某些氮肥与碱性肥料混合施用会释出氨,用离子方程式解释________________________。
(3)经过研究发现我国的霾呈中性,其主要原因如下图所示,A的化学式是________。
2NH3(气)+SO2(气)+2NO2(气)![]() 2NH4+(溶液)+A(溶液)+2HONO(气)
2NH4+(溶液)+A(溶液)+2HONO(气)
(4)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下(其他极微量离子忽略不计):
离子 | Na+ | SO42- | NO3- | H+ | Cl |
浓度/(mol·L1) | 5.5×103 | 8.5×104 | y | 2.8×104 | 3.5×103 |
①NO和NaClO2溶液反应的离子方程式是___________________。
②表中y=_______。
(5)工业生产硝酸也有可能产生NOx污染。请写出硝酸生产中的第一步:氨的催化氧化的化学方程式___________________________________。