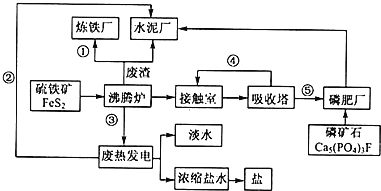
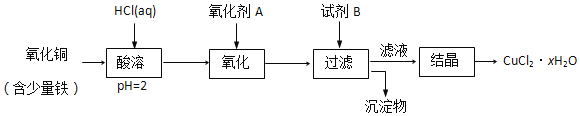
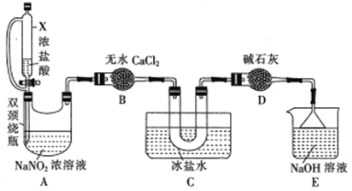
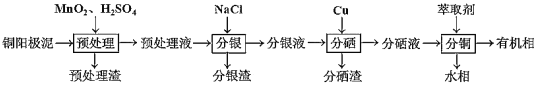
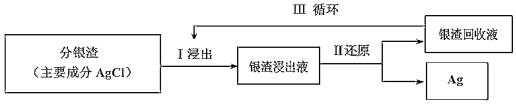
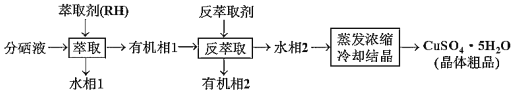
题目内容
【题目】愈创木酚作原料合成香草醛的路线如图所示,下列说法正确的是( )
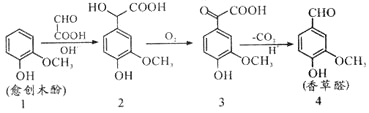
A.检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
B.化合物2在一定条件下可发生加聚反应
C.理论上反应1→2中原子利用率100%
D.等物质的量的四种物质与足量NaOH溶液反应,消耗NaOH物质的量比为1:3:2:1
【答案】C
【解析】
试题分析:A.香草醛与化合物3中都含有酚羟基,遇氯化铁溶液都变紫色,故A错误;B.化合物2分子中含有羧基、醇羟基,可以通过形成酯基发生缩聚反应生成高聚物,故B错误;C.由原子可知,化合物1HOOC-CHO的原子全部生成化合物2,没有其它物质生成,反应1→2中原子利用率为100%,故C正确;D.化合物1中酚羟基与NaOH反应,1mol化合物1含有1mol酚羟基,化合物2含有酚羟基、羧基与NaOH反应,1mol化合物2含有1mol酚羟基、1mol羧基,化合物3含有酚羟基、羧基与NaOH反应,1mol化合物3含有1mol酚羟基、1mol羧基,化合物4中含有酚羟基与NaOH反应,1mol化合物1含有1mol酚羟基,故1mol的化合物1、化合物2、化合物3、化合物4分别与足量NaOH反应,消耗NaOH物质的量之比为1mol:2mol:2mol:1mol=1:2:2:1,故D错误。

 开心蛙状元测试卷系列答案
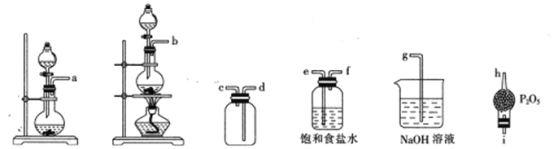
开心蛙状元测试卷系列答案【题目】食用二氧化硫漂白过的食品,对人体的肝、肾脏等有严重损害。某科研小组设计实验检验二氧化硫的漂白性。回答下列问题:
(一)二氧化硫的制备
实验室一般采用亚硫酸钠与硫酸(浓硫酸与水1:1混合)反应制取二氧化硫
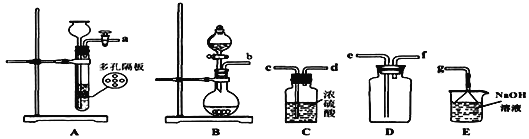
(1)写出实验室制SO2的化学方程式________________________________;
(2)欲收集一瓶干燥的二氧化硫,选择上图中的装置,其最佳连接顺序为:_______________________________________(按气流方向,用小写字母表示)。
(二)二氧化硫性质的检验
将上述收集到的SO2通入下列装置中,在一定温度下按图示装置进行实验。

(2)根据上述实验,回答下列问题:
序号 | 实验现象 | 解释原因 |
① | _________________________ | _________________________ |
② | 品红试液褪色 | SO2具有漂白性 |
③ | ________________________ | 反应的离子方程式____________________ |
④ | 溶液变浑浊,有黄色沉淀生成 | SO2+2H2S=3S↓+2H2O |
(3)用SO2漂白过的食品中一般残留有亚硫酸盐,科研小组设计了检验食品中是否含有亚硫酸盐的简单方法:将食品剪成碎末放入烧杯,加入适量的水,加热一会儿,冷却至室温,滴加盐酸和试剂A,观察液体的颜色变化既可。
①上述检验中试剂A是_____________。
②加热的作用是加快反应速率(或加快食品的溶解),加热时间不能太长的原因是_________________________________________________________________。