题目内容
7.用水稀释0.1mol•L-1氨水时,溶液中随着水量的增加而减小的是( )| A. | $\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | c(OH-)•c(H+) | ||
| C. | c (OH-) | D. | H+的物质的量 |
分析 用水稀释0.1mol/L氨水时,溶液中随着水量的增加,由NH3.H2O?OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3.H2O)减少.
解答 解:A、由NH3.H2O?OH-+NH4+可知,加水促进电离,平衡正向移动,则n(NH3.H2O)减少,n(NH4+)增大,V相同,二者的比值增大,故A错误;
B、因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故B错误;
C、氨水加水稀释,溶液的浓度减小,碱性减弱,氢氧根的浓度减小,根据温度不变,则c(H+)和c(OH-)的乘积不变,所以氢氧根的浓度减小,氢离子浓度增大,故C正确;
D、氨水加水稀释,溶液碱性减弱,氢氧根离子浓度减小,c(H+)和c(OH-)的乘积不变,所以氢离子浓度增大,其物质的量增大,故D错误;
故选C.
点评 本题考查弱电解质的电离,明确稀释时电离平衡的移动及离子的物质的量、离子的浓度的变化是解答的关键,并注意离子积与温度的关系来解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.某药物中间体X的结构如图所示,下列说法正确的是( )


| A. | 该X的分子式为C23H25N2O3 | |
| B. | 每个X分子中含有2个手性碳原子 | |
| C. | 1 mol X最多能与9 mol H2发生加成反应 | |
| D. | X能发生水解、氧化和消去反应 |
12.下列说法正确的是( )
| A. | 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>b>c | |
| B. | 常温下5.0×10-3mol/LKHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A) | |
| C. | 室温时,M(OH)2(s)?M2+(aq)+2OH-(aq)Ksp=a; 当含M(OH)2固体的悬浊液中 c(M2+)=b mol/L时,溶液的pH等于14+$\frac{1}{2}1g(\frac{b}{a})$ | |
| D. | 图中a点溶液中各离子浓度的关系是: c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
19.下列说法正确的是( )
| A. | 对于有气体参与的化学平衡体系,增大压强,反应速率一定加快 | |
| B. | 常温下,反应4Fe(OH)2(S)+2H2O(l)+O2(g)=4Fe(OH)3(S)的△H<0,△S<0 | |
| C. | 用0.1mol/L醋酸滴定0.lmol/L NaOH溶液至中性时:c(CH3COO -)+c(CH3COOH)<c(Na+) | |
| D. | 向纯水中加入盐类物质,有可能促进水的电离平衡,但不可能抑制水的电离 |
16.下列说法正确的是( )
| A. | 单位物质的量的气体所占的体积就是气体摩尔体积 | |
| B. | 摩尔是物质的量的单位 | |
| C. | 阿伏加德罗常数就是6.02×1023 | |
| D. | CO2的摩尔质量为44g |
17.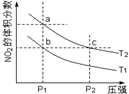 为了探索外界条件对反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如图所示.下列说法正确的是( )
为了探索外界条件对反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如图所示.下列说法正确的是( )
 为了探索外界条件对反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如图所示.下列说法正确的是( )
为了探索外界条件对反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如图所示.下列说法正确的是( )| A. | a、c两点气体的平均相对分子质量:a>c | |
| B. | a、c两点气体的颜色:a浅,c深 | |
| C. | b、c两点的平衡常数:Kb=Kc | |
| D. | 状态a通过升高温度可变成状态b |
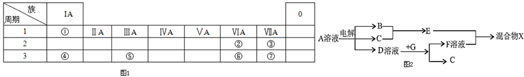

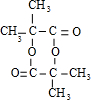 .
. ;E→F:2(CH3)2C(OH)-CH2OH+O2$→_{△}^{Cu}$2(CH3)2C(OH)-CHO+2H2O.
;E→F:2(CH3)2C(OH)-CH2OH+O2$→_{△}^{Cu}$2(CH3)2C(OH)-CHO+2H2O.
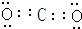 ,Z与氢元素形成的化合物溶于水后,溶液的pH>7(填“<”、“>”或“=”).
,Z与氢元素形成的化合物溶于水后,溶液的pH>7(填“<”、“>”或“=”).