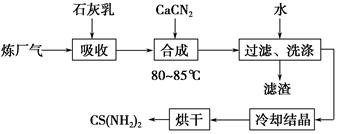
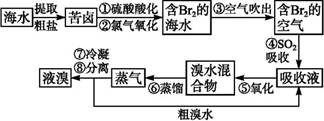
题目内容
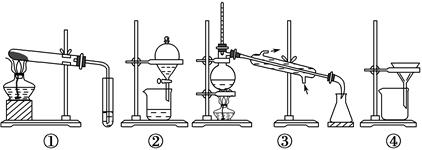
某研究性学习小组设计以下装置制取氯气,并以氯气为原料进行特定反应。分析并回答下列问题:
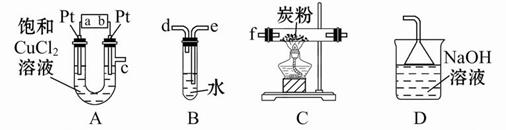
(1)装置A中,b 为电池的 (填“正”或“负”)极。
(2)实验开始时,先让氯气和水蒸气充满装有炭粉的装置C,再点燃C处的酒精灯,装置C中发生氧化还原反应,生成CO2和HCl(g),则反应的化学方程式为:
。
(3)要将装置B接入装置A和C之间,正确的连接顺序是:c→ → →f
(4)实验结束后,将装置B试管中的氯水倒入已检查完好的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞,振荡,静置于铁架台上(如图)
等分层后取上层液和下层液,呈黄绿色的是 (填“上层液”或“下层液”),该层液体能否使干燥的有色布条褪色? (填“能”或“不能”)。
(5)若装置A中产生的氯气恰好能与100 mL 4 mol/L的NaOH溶液完全反应,则此时A中Pt电极(阴极)增加的质量为 g。

(1)装置A中,b 为电池的 (填“正”或“负”)极。
(2)实验开始时,先让氯气和水蒸气充满装有炭粉的装置C,再点燃C处的酒精灯,装置C中发生氧化还原反应,生成CO2和HCl(g),则反应的化学方程式为:
。
(3)要将装置B接入装置A和C之间,正确的连接顺序是:c→ → →f
(4)实验结束后,将装置B试管中的氯水倒入已检查完好的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞,振荡,静置于铁架台上(如图)

等分层后取上层液和下层液,呈黄绿色的是 (填“上层液”或“下层液”),该层液体能否使干燥的有色布条褪色? (填“能”或“不能”)。
(5)若装置A中产生的氯气恰好能与100 mL 4 mol/L的NaOH溶液完全反应,则此时A中Pt电极(阴极)增加的质量为 g。
(1)正
(2)2Cl2+C+2H2O 4HCl+CO2
4HCl+CO2
(3)e d (4)下层液 不能
(5)12.8
(2)2Cl2+C+2H2O
 4HCl+CO2
4HCl+CO2(3)e d (4)下层液 不能
(5)12.8
(1)观察装置A发现,在右边有导管,故此处有氯气冒出,此极应为电解池的阳极,与电源的正极相连;
(2)根据提供的物质进行书写化学方程式,反应物有炭粉、氯气和水蒸气;
(3)在装置A和C之间,B装置的作用是冒出氯气和水蒸气的混合气体,应是“长进短出”,故连接顺序为c→e→d→f;
(4)B装置中所得的混合液为氯水,故在加入四氯化碳时,氯气易溶解于CCl4之中,由于CCl4密度较大,故处于液体的下层;由于其中无水,故无次氯酸,不能使干燥的布条褪色。
(5)由氯气与NaOH溶液完全反应,Cl2+2NaOH=NaCl+NaClO+H2O,可求出n(Cl2)=" 0.2" mol;再根据反应CuCl2=Cu+Cl2↑可求出析出铜的质量为
0.2 mol×64 g/mol="12.8" g
(2)根据提供的物质进行书写化学方程式,反应物有炭粉、氯气和水蒸气;
(3)在装置A和C之间,B装置的作用是冒出氯气和水蒸气的混合气体,应是“长进短出”,故连接顺序为c→e→d→f;
(4)B装置中所得的混合液为氯水,故在加入四氯化碳时,氯气易溶解于CCl4之中,由于CCl4密度较大,故处于液体的下层;由于其中无水,故无次氯酸,不能使干燥的布条褪色。
(5)由氯气与NaOH溶液完全反应,Cl2+2NaOH=NaCl+NaClO+H2O,可求出n(Cl2)=" 0.2" mol;再根据反应CuCl2=Cu+Cl2↑可求出析出铜的质量为
0.2 mol×64 g/mol="12.8" g

练习册系列答案
相关题目